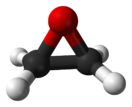
Оксира́н (этиленокси́д, о́кись этиле́на, 1,2-эпоксиэтáн) — органическое гетероциклическое вещество, химическая формула C2H4O. При нормальных условиях — бесцветный газ с характерным сладковатым запахом. Производное этилена и представляет собой простейший эпоксид — трёхчленный гетероцикл, в кольцевой молекуле которого содержатся один атом кислорода и два атома углерода.
| Окись этилена | |||
|---|---|---|---|
  | |||
| Общие | |||
| Систематическое наименование |
оксиран | ||
| Традиционные названия | этиленоксид, 1,2-эпоксиэтан, этилена окись | ||
| Хим. формула | C2H4O | ||
| Рац. формула | C2H4O | ||
| Физические свойства | |||
| Состояние | газ | ||
| Молярная масса | 44,0526 г/моль | ||
| Плотность | (относительно воды[прояснить] при температуре 10 °C для жидкой окиси этилена)[1] 0,8824 г/см³ | ||
| Энергия ионизации | 10,56 ± 0,01 эВ[5] и 10,57 эВ[6] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −111,3[2] | ||
| • кипения | 10,7[3] °C | ||
| • вспышки | < −18[3] °C | ||
| Пределы взрываемости | 3 ± 1 об.%[5] | ||
| Критическая точка | 195,8 °C; 7,19 МПа[3] | ||
| Мол. теплоёмк. | 48,19[4] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −51,04[4] кДж/моль | ||
| Удельная теплота испарения | 25,82[3] | ||
| Удельная теплота плавления | 5,17[3] | ||
| Давление пара | 145,8 кПа (при 20 °C)[3] | ||
| Оптические свойства | |||
| Показатель преломления | 1,35965 (при 7 °C)[4] | ||
| Структура | |||
| Дипольный момент | 6,3E−30 Кл·м[6] | ||
| Классификация | |||
| Рег. номер CAS | 75-21-8 | ||
| PubChem | 6354 | ||
| Рег. номер EINECS | 200-849-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | KX2450000 | ||
| ChEBI | 27561 | ||
| ChemSpider | 6114 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м³ | ||
| ЛД50 | 72 мг/кг | ||
| Токсичность | высокая | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Благодаря особенностям электронной структуры молекулы, окись этилена легко вступает в реакции присоединения с раскрытием гетероцикла и поэтому легко подвергается полимеризации.
Смесь паров вещества с воздухом является чрезвычайно огне- и взрывоопасной.
Окись этилена обладает дезинфицирующими свойствами, то есть, является сильным ядом для большинства известных микроорганизмов даже в газообразном виде, что используется для газовой стерилизации, например, одноразовых медицинских шприцев.
Также является медленно действующим сильным ядом для теплокровных животных и человека, проявляя канцерогенное, мутагенное, раздражающее и наркотическое действие.
Окись этилена является одним из важных веществ в основном органическом синтезе и широко используется для получения многих химических веществ и полупродуктов, в частности этиленгликолей, этаноламинов, простых и сложных гликолевых и полигликолевых эфиров и прочих соединений.
В химической промышленности окись этилена получают прямым окислением этилена в присутствии серебряного катализатора.
История открытия
правитьЭтиленоксид был открыт в 1859 году французским химиком-органиком Шарлем Адольфом Вюрцем действием гидроксида калия на 2-хлорэтанол[7]:
Учёный был первым, кто исследовал свойства этого вещества, измерив температуру его кипения[8], а также обнаружил его способность вступать в реакцию c солями металлов и кислотами[9]. Вюрц ошибочно предположил, что окись этилена обладает свойствами органического основания. Это заблуждение продержалось до 1896 года, пока учёные Георг Бредиг и Алексей Усов (нем. Usoff) не обнаружили, что этиленоксид не является электролитом[9].
Резкое отличие вещества от простых эфиров и, в частности, склонность его к реакциям присоединения аналогично непредельным соединениям, долгое время было причиной дискуссий химиков вокруг молекулярной структуры окиси этилена. Только в 1893 году была предположена гетероцикличная трёхчленная структура этиленоксида с искажёнными углами по сравнению с другими кислородсодержащими органическими соединениями[9].
Первый способ получения окиси этилена долгое время оставался единственным, несмотря на многочисленные попытки учёных, включая самого Вюрца, синтезировать соединение напрямую из этилена[10]. Только в 1931 году французский химик Теодор Лефорт разработал метод прямого окисления этилена в присутствии серебряного катализатора[11]. Это способ в конце XX века стал основным методом современного промышленного производства окиси этилена.
Строение и параметры молекулы
правитьЭпоксидный цикл окиси этилена представляет собой практически правильный треугольник с валентными углами около 60° и значительным угловым напряжением[12], для сравнения в спиртах угол C−O−H составляет около 110°, в простых эфирах угол C−O−С: 120°. Величина этого напряжения оценивается энергией в 105 кДж/моль[13]. Моменты инерции относительно главных осей: IA = 32,921⋅10−40 г·см², IB = 37,926⋅10−40 г·см², IC = 59,510⋅10−40 г·см²[14].
Относительную неустойчивость углерод-кислородных связей в молекуле показывает сравнение энергии разрыва двух связей C−O в окиси этилена с энергией разрыва одной связи C−O в этаноле и диметиловом эфире: они близки по значению — разница составляет 12,7 % и 5,9 % соответственно[15]:
| Уравнение реакции | ΔHo298, кДж/моль | Метод определения |
|---|---|---|
| (C2H4)O → C2H4 + O (разрыв двух связей) | 354,38 | Вычислено, исходя из энтальпий образования атомов |
| C2H5OH → C2H5 + OH (разрыв одной связи) | 405,85 | Электронный удар |
| CH3OCH3 → CH3O + CH3 (разрыв одной связи) | 334,72 | Вычислено, исходя из энтальпий образования радикалов |
Особенности строения молекулы окиси этилена определяют его химическую активность и объясняют лёгкость раскрытия цикла в многочисленных реакциях присоединения (см. раздел «Химические свойства»).
Физические свойства
правитьОкись этилена — бесцветный газ (при 25 °C) или подвижная жидкость[16] (при 0 °C) с характерным эфирным сладковатым запахом, ощутимым при концентрации в воздухе свыше 500 частей на миллион[17]. Хорошо растворима в воде, спирте, эфире и многих других органических растворителях[2]. Температура кипения: 10,7 °C; температура плавления: −111,3 °C; плотность жидкой окиси этилена при температуре 10 °C относительно воды при той же температуре: 0,8824.
Основные термодинамические характеристики[4]:
- стандартная молярная теплоёмкость вещества, Сop = 48,19 Дж/(моль·К);
- стандартная энтальпия образования, ΔHo298 = −51,037 кДж/моль;
- стандартная энтропия, So298 = 243,4 Дж/(моль·К);
- стандартная энергия Гиббса образования, ΔGo298 = −11,68 кДж/моль;
- теплота сгорания, ΔHoсгор. = −1306 кДж/моль[3].
Некоторые физические константы окиси этилена:
- Поверхностное натяжение в жидком состоянии на границе с собственным паром[18]:
T, °C σ, мДж/м² −50,1 35,8 −0,1 27,6
- Температура кипения при давлении пара выше 101,3 кПа[19]:
P, МПа P, атм T, °C 0,507 5 57,7 1,013 10 83,6 2,027 20 114,0
T, °C η, 10−3 Па·с −49,8 0,577 −38,2 0,488 −21,0 0,394 0,0 0,320
- Уравнение зависимости давления пара в интервале от −91 до 10,5 °C[21]:
- lg(p [мм рт. ст.]) = 6,251 − 1115,1 / (244,14 + t [°C]).
- Дипольный момент при температуре 17—176 °C[22]:
- 6,26⋅10−30 Кл·м (1,89 Д).
Физические свойства жидкой окиси этилена в температурном диапазоне от −40 до 195,8 °C[10]:
| Температура, °C |
Давление пара, кПа |
Энтальпия жидкости, Дж/г |
Энтальпия испарения, Дж/г |
Плотность, кг/л |
Теплоёмкость, Дж/(кг·К) |
Теплопроводность, Вт/(м·К) |
|---|---|---|---|---|---|---|
| −40 | 8,35 | 0 | 628,6 | 0,9488 | 1878 | 0,20 |
| −20 | 25,73 | 38,8 | 605,4 | 0,9232 | 1912 | 0,18 |
| 0 | 65,82 | 77,3 | 581,7 | 0,8969 | 1954 | 0,16 |
| +20 | 145,8 | 115,3 | 557,3 | 0,8697 | 2008 | 0,15 |
| +40 | 288,4 | 153,2 | 532,1 | 0,8413 | 2092 | 0,14 |
| +60 | 521,2 | 191,8 | 505,7 | 0,8108 | 2247 | 0,14 |
| +80 | 875,4 | 232,6 | 477,4 | 0,7794 | 2426 | 0,14 |
| +100 | 1385,4 | 277,8 | 445,5 | 0,7443 | 2782 | 0,13 |
| +120 | 2088 | 330,4 | 407,5 | 0,7052 | 3293 | н/д[23] |
| +140 | 3020 | 393,5 | 359,4 | 0,6609 | 4225 | н/д |
| +160 | 4224 | 469,2 | 297,1 | 0,608 | н/д | н/д |
| +180 | 5741 | 551,2 | 222,5 | 0,533 | н/д | н/д |
| +195,8 | 7191 | н/д | н/д | н/д | н/д | н/д |
Физические свойства паров окиси этилена в температурном диапазоне от 298 до 800 К[10]:
| Температура, К | Энтропия, Дж/(моль·К) | Теплота образования, кДж/моль | Свободная энергия образования, кДж/моль | Вязкость, Па·с | Теплопроводность, Вт/(м·К) | Теплоёмкость, Дж/(моль·К) |
|---|---|---|---|---|---|---|
| 298 | 242,4 | −52,63 | −13,10 | н/д | н/д | 48,28 |
| 300 | 242,8 | −52,72 | −12,84 | 9,0 | 0,012 | 48,53 |
| 400 | 258,7 | −56,53 | 1,05 | 13,5 | 0,025 | 61,71 |
| 500 | 274,0 | −59,62 | 15,82 | 15,4 | 0,038 | 75,44 |
| 600 | 288,8 | −62,13 | 31,13 | 18,2 | 0,056 | 86,27 |
| 700 | 302,8 | −64,10 | 46,86 | 20,9 | 0,075 | 95,31 |
| 800 | 316,0 | −65,61 | 62,80 | н/д | 0,090 | 102,9 |
Химические свойства
правитьБлагодаря особенностям молекулярной структуры (см. раздел «Строение и параметры молекулы»), окись этилена является весьма реакционноспособным соединением и легко вступает в реакции с различными соединениями с разрывом связи C−O и раскрытием цикла. Для соединения наиболее характерны реакции с нуклеофилами, проходящие по механизму SN2 как в кислой (слабые нуклеофилы: вода, спирты), так и щелочной среде (сильные нуклеофилы: OH−, RO−, NH3, RNH2, RR’NH и пр.)[13].
Общий вид реакций:
Далее будут рассмотрены наиболее типичные химические реакции с участием окиси этилена.
Присоединение воды и спиртов
правитьВодные растворы окиси этилена довольно устойчивы и могут длительное время существовать без заметного протекания химической реакции, однако добавление небольшого количества кислоты[24] сразу же приводит к образованию этиленгликоля даже при комнатной температуре:
Реакцию можно проводить и в газовой фазе, используя в качестве катализатора соли фосфорной кислоты[25].
Обычно, на практике, реакцию проводят при температуре около 60 °C при большом избытке воды, чтобы исключить реакцию образовавшегося этиленгликоля с этиленоксидом, в результате чего образуются ди- и триэтиленгликоли[26]:
Использование щелочных катализаторов может привести к образованию полиэтиленгликоля:
Аналогично протекает реакция со спиртами, в результате чего образуются эфиры этиленгликоля (целлозольвы):
Реакция с низшими спиртами протекает менее активно, чем с водой, требует более жёстких условий (нагревание до 160 °C, давление до 3 МПа) и присутствия кислотного или щелочного катализатора.
Реакция окиси этилена с высшими жирными спиртами, используемая для получения поверхностно-активных соединений, протекает в присутствии металлического натрия, гидроксида натрия или трифторида бора[25].
Присоединение карбоновых кислот и их производных
правитьПри взаимодействии окиси этилена в присутствии катализаторов с карбоновыми кислотами получаются неполные, а с ангидридами кислот — полные эфиры гликолей:
По аналогии возможно и присоединение амидов кислот:
Присоединение окиси этилена к высшим карбоновым кислотам производят при повышенной температуре (обычно 140—180 °C) и давлении (0,3—0,5 МПа) в инертной атмосфере в присутствии щелочного катализатора (концентрация: 0,01—2 %) — гидроксида или карбоната натрия (калия)[27]. В качестве нуклеофила в реакции выступает карбоксилат-ион:
Присоединение аммиака и аминов
правитьОкись этилена вступает в реакцию с аммиаком[28], образуя смесь моно-, ди- и триэтаноламина:
Аналогично может протекать реакция и с первичными и вторичными аминами:
Диалкиламиноэтанолы могут дальше реагировать с окисью этилена, образуя аминополиэтиленгликоли[10]:
Триметиламин реагирует с окисью этилена в присутствии воды, образуя холин[29]:
Ароматические первичные и вторичные амины также реагируют с окисью этилена, образуя соответствующие ариламиноспирты.
Присоединение галогеноводородов
правитьОкись этилена легко реагирует с водными растворами галогеноводородов HCl, HBr и HI[30] с образованием галогенгидринов:
Реакция с галогеноводородами в водном растворе конкурирует с кислотно катализируемой гидратацией окиси этилена, поэтому всегда в качестве побочного продукта будет образовываться этиленгликоль с примесью диэтиленгликоля. Для получения более чистого продукта, можно проводить реакцию в газовой фазе или в среде органического растворителя.
Этиленфторгидрин получают иначе: взаимодействием фтористого водорода с 5—6%-м раствором окиси этилена в диэтиловом эфире с содержанием воды 1,5—2 %[31] при кипячении[32].
Галогенгидрины также можно получить, пропуская окись этилена через водные растворы галогенидов металлов[25]:
Присоединение металлорганических соединений
правитьВзаимодействие окиси этилена с магнийорганическими соединениями (реактивами Гриньяра) можно рассматривать как нуклеофильное замещение под действием карбаниона металлоорганического соединения. Конечным продуктом реакции будет первичный спирт:
Помимо реактивов Гриньяра по аналогичной схеме присоединяются и другие металлорганические соединения, например, алкиллитий:
Прочие реакции присоединения
правитьПрисоединение цианистого водорода
правитьЭтиленоксид легко вступает в реакцию с цианистым водородом с образованием этиленциангидрина:
Вместо HCN можно применять охлаждённый (10—20 °C) водный раствор цианида кальция[33]:
Этиленциангидрин легко теряет воду, образуя акрилонитрил:
Присоединение сероводорода и меркаптанов
правитьВзаимодействуя с сероводородом, окись этилена образует 2-меркаптоэтанол и тиодигликоль, с алкилмеркаптанами получается 2-алкилмеркаптоэтанол:
Избыток окиси этилена с водным раствором сероводорода приводит к трис-(гидроксиэтил)сульфония гидроксиду:
Присоединение азотистой и азотной кислот
правитьВзаимодействие окиси этилена с водными растворами нитритов бария, кальция, магния или цинка, а также с раствором нитрита натрия с углекислым газом, приводит к образованию 2-нитроэтанола[34]:
Реакция окиси этилена с азотной кислотой приводит к моно- и динитрогликолю[35]:
Реакция с соединениями, содержащими активную метиленовую группу
правитьРеакция окиси этилена с соединениями, содержащими активную метиленовую группу, в присутствии алкоголятов приводит к образованию бутиролактонов[36]:
Присоединение к ароматическим соединениям
правитьОкись этилена вступает в реакцию Фриделя — Крафтса с бензолом с образованием фенилэтилового спирта:
Проводя реакцию в других условиях (температура 315—440 °C, давление 0,35—0,7 МПа, катализатор: алюмосиликат), можно получить в одну стадию стирол[37].
Реакции синтеза краун-эфиров
правитьС помощью окиси этилена можно получить ряд многочленных гетероциклических соединений, известных как краун-эфиры.
Один из известных методов заключается в катионной циклополимеризации окиси этилена с ограничением размера образующегося цикла[38]:
Для подавления образования побочных линейных полимеров используют метод высокого разбавления — реакцию проводят в сильно разбавленном растворе[38].
Интересной является реакция окиси этилена с SO2 в присутствии солей цезия, приводящая к образованию одиннадцатичленного гетероциклического соединения, обладающего комплексообразующими свойствами краун-эфиров[39]:
Реакция изомеризации
правитьПри нагревании окиси этилена при температуре около 400 °C или 150—300 °C в присутствии катализаторов (Al2O3, H3PO4 и пр.) происходит изомеризация в ацетальдегид[40]:
Радикальный механизм, предложенный Бенсоном (англ. Sidney W. Benson) для объяснения реакции, происходящей в газовой фазе, включает в себя следующие стадии[41][42]:
Частица ( ) представляет собой короткоживущую (время жизни 10−8,5 секунд) активированную молекулу ацетальдегида, избыточная энергия которой составляет примерно 355,6 кДж/моль, что на 29,3 кДж/моль больше энергии диссоциации связи C-C в ацетальдегиде[41].
Термическую изомеризацию окиси этилена в отсутствие катализатора невозможно провести селективно с образованием ацетальдегида, так как в этих условиях заметны параллельные радикальные реакции и существенна доля побочных продуктов (см. подраздел «Термическое разложение»)[43].
Реакции восстановления
правитьОкись этилена может быть подвергнута гидрированию с образованием этилового спирта в присутствии катализатора:
В качестве катализаторов прямого гидрирования могут выступать никель, платина и палладий[43]. Также в качестве агентов гидрирования возможно использование алюмогидрида лития, боранов и некоторых других гидридов[44].
Окись этилена может также восстанавливаться водородом в момент выделения (реакция цинковой пыли с уксусной кислотой) до этилена (выход до 70 %)[44]:
Аналогично реакция идёт в присутствии смеси алюмогидрида лития с хлоридом титана (III)[45], хлорида железа с бутиллитием в среде тетрагидрофурана, а также некоторыми другими агентами[44].
Реакции окисления
правитьОкись этилена может быть окислена в зависимости от условий до гликолевой кислоты или до диоксида углерода:
Глубокое газофазное окисление окиси этилена в реакторе при температуре 800—1000 К и давлении 0,1—1 МПа приводит к смеси продуктов, содержащей O2, H2, CO, CO2, CH4, C2H2, C2H4, C2H6, C3H6, C3H8, CH3CHO[46].
Реакции димеризации
правитьВ присутствии кислотных катализаторов можно провести димеризацию окиси этилена с образованием диоксана:
Механизм реакции выглядит следующим образом[43]:
Реакция димеризации не является селективной, так как в ходе её проведения всегда образуются побочные продукты и, в частности, ацетальдегид (вследствие реакции изомеризации).
Для ускорения и повышения селективности реакции можно использовать платиновые или платино-палладиевые катализаторы, а также элементарный йод вместе с сульфоланом (в этом случае в качестве побочного продукта образуется 2-метил-1,3-диоксолан)[47].
Реакции полимеризации
правитьЖидкая окись этилена под действием различных факторов может образовывать полиэтиленгликоли. Процесс полимеризации может иметь как радикальный, так и ионный механизм, но в практическом плане только последний имеет широкое использование[48].
Катионная полимеризация окиси этилена протекает под действием протонных кислот (HClO4, HCl), кислот Льюиса (SnCl4, BF3 и пр.), металлорганических соединений или более сложных, многокомпонентных составов[48]:
Механизм реакции выглядит следующим образом[49].
На первой стадии происходит инициация катализатора (MXm) под действием алкил- или ацилгалогенида или соединения с активным атомом водорода, обычно воды, спирта или гликоля:
Образующийся активный комплекс вступает в реакцию с окисью этилена по SN2-механизму:
Обрыв цепи:
Анионная полимеризация окиси этилена протекает под действием оснований: алкоголятов, гидроксидов, карбонатов или других соединений щелочных или щёлочноземельных металлов[48].
Механизм реакции выглядит следующим образом[49]:
Термическое разложение
правитьОкись этилена термически устойчивое соединение — в отсутствие катализаторов до 300 °C она не подвергается термолизу, и только после 570 °C начинается заметный процесс экзотермического разложения, протекающий по радикальному механизму[43]. На первом этапе происходит изомеризация (см. подраздел «Реакция изомеризации»), однако с увеличением температуры радикальный процесс ускоряется, и в качестве продуктов реакции получается газовая смесь, содержащая помимо ацетальдегида этан, этилен, метан, водород, оксид углерода (II), кетен, формальдегид[50].
Высокотемпературный пиролиз (830—1200 К) при повышенном давлении в инертной среде приводит к более сложному составу газовой смеси, в котором дополнительно обнаруживаются ацетилен и пропан[51].
Инициация цепи, в отличие от реакции изомеризации, происходит в основном следующим образом[51]:
Проводя термическую деструкцию окиси этилена в присутствии соединений переходных металлов в качестве катализаторов, можно не только уменьшить её температуру, но и получить в качестве основного продукта этилен, то есть фактически провести реакцию обратную синтезу окиси этилена прямым окислением.
Прочие реакции
правитьПод действием тиоцианат-ионов или тиомочевины окись этилена превращается в тииран (сульфид этилена)[52]:
Пентахлорид фосфора, взаимодействуя с окисью этилена, образует дихлорэтан[25]:
По аналогии дихлорпроизводные из окиси этилена можно получить действием SOCl2 и пиридином, трифенилфосфином и CCl4[53].
Трихлорид фосфора с окисью этилена образует хлорэтиловые эфиры фосфористой кислоты[25]:
Продуктом реакции оксида этилена с хлорангидридами карбоновых кислот в присутствии иодида натрия является сложный йодэтильный эфир[53]:
При нагревании окиси этилена с диоксидом углерода в среде неполярного растворителя при 100 °C в присутствии бис-(трифенилфосфин)-никеля(0) образуется этиленкарбонат[54]:
В промышленности подобную реакцию проводят при повышенном давлении и температуре в присутствии четвертичных аммониевых или фосфониевых солей в качестве катализатора[55].
Реакция окиси этилена с формальдегидом в присутствии катализатора при температуре 80—150 °C приводит к образованию 1,3-диоксолана[56]:
Если вместо формальдегида использовать другие альдегиды или кетоны, можно получить 2-замещённые 1,3-диоксоланы (выход 70—85 %, катализатор: тетраэтиламмонийбромид)[56].
Каталитическое гидроформилирование окиси этилена приводит к образованию гидроксипропаналя и далее пропан-1,3-диола[57]:
Лабораторные методы получения
правитьДегидрохлорирование этиленхлоргидрина или его производных
правитьДегидрохлорирование этиленхлоргидрина, открытое ещё Вюрцем, до сих пор остаётся одним из распространённых лабораторных методов получения окиси этилена:
Реакцию проводят при нагревании, при этом, помимо гидроксида натрия или калия, можно воспользоваться гидроксидами кальция, бария или магния, а также карбонатами щелочных или щёлочноземельных металлов[58].
В свою очередь, в лаборатории этиленхлоргидрин получают одним из перечисленных ниже методов[58]:
- реакция этиленгликоля с хлористым водородом:
- реакция этилена с хлорноватистой кислотой:
или
Удобным и одним из старейших препаративных методов получения окиси этилена является действие щёлочи на хлорэтилацетат[59]:
С высоким выходом (до 90 %) можно получить окись этилена действием оксида кальция (с другими щелочами выход реакции снижается) на этилгипохлорит[59]:
В свою очередь, этилгипохлорит получают по реакции:
Прямое окисление этилена пероксикислотами
правитьДля эпоксидирования этилена в лабораторных условиях используют пероксикислоты, например, пероксибензойную или мета-хлорпероксибензойную кислоты[60]:
Окисление перкислотами эффективно для высших алкенов, но их использование для этилена, хотя и возможно, на практике может быть не вполне оправдано из-за продолжительности проведения и низкого выхода реакции[59].
Прочие препаративные методы
правитьСреди прочих препаративных методов можно отметить следующие[59]:
- реакция 1,2-дииодэтана с оксидом серебра:
- разложение этиленкарбоната при 200—210 °C в присутствии гексахлорэтана:
Из последних публикаций упомянем использование смешанного литий-серебро-алюминиевого катализатора для прямого окисления этанола в окись этилена[61]:
Промышленное производство
правитьИстория промышленного производства окиси этилена
правитьНачало промышленного производства окиси этилена датируется 1914 годом, когда был запущен хлоргидриновый процесс (реакция этиленхлоргидрина с гидроксидом кальция), монопольно просуществовавший до 1937 года. Первый завод по производству окиси этилена был построен во время Первой мировой войны компанией BASF[62]. Хлоргидриновый процесс изначально был не вполне эффективен, даже не беря в расчёт экономические показатели, так как в его результате терялся ценный хлор в виде хлорида кальция.
Начиная с 1930-х годов этот процесс начал вытесняться прямым газофазным окислением этилена воздухом, а начиная с 1958 года — кислородом, в присутствии серебряного катализатора, при давлении 1—3 МПа и температуре 200—300 °C (прямое окисление этилена было открыто в 1931 году Лефортом)[63].
Более экономичный способ прямого окисления этилена к середине 1950-х годов в США обеспечивал примерно половину всей производимой окиси этилена, а после 1975 года полностью вытеснил старый метод[63].
В Советском Союзе первое промышленное производство окиси этилена, осуществлённое в соответствии с хлоргидриновым процессом, было запущено в 1936 году[64]; одновременно проводились интенсивные поиски более экономичной технологии. Работы над созданием собственного метода получения окиси этилена прямым окислением этилена на серебряном катализаторе велись под руководством профессора П. В. Зимакова в 1938—1942 годах.[65], что легло в основу первого отечественного промышленного производства получения окиси этилена прямым каталитическим окислением этилена, запущенного вскоре после Великой Отечественной войны[64].
Хлоргидриновый процесс производства окиси этилена
правитьХлоргидриновый процесс был первым промышленным методом производства окиси этилена, и хотя на начало XXI века он полностью вытеснен методом прямого окисления этилена, знакомство с ним представляет не только исторический интерес, но и практический: метод до сих пор используется в производстве окиси пропилена[66].
Технологически хлоргидриновый процесс состоит из следующих этапов:
- получение этиленхлоргидрина;
- дегидрохлорирование этиленхлоргидрина с получением окиси этилена;
- очистка окиси этилена.
На практике окись этилена получают непрерывным методом. В первой реакционной колонне происходит гипохлорирование этилена с образованием этиленхлоргидрина[67]:
Для уменьшения превращения этилена в дихлорэтан (реакция [3]) концентрацию этиленхлоргидрина поддерживают на уровне 4—6 %, а сам раствор подогревают паром до температуры кипения[67].
Далее водный раствор этиленхлоргидрина поступает во вторую реакционную колонну, где он вступает в реакцию с 30%-м раствором гидроксида кальция при температуре 100 °C[67]:
Очистку окиси этилена от примесей осуществляют ректификацией. Хлоргидриновый процесс позволяет достичь 95 % степени превращения по этилену, выход окиси этилена составляет 80 % от теоретического; на 1 тонну образующегося продукта получается около 200 кг дихлорэтана[67].
Процесс производства окиси этилена прямым окислением этилена
правитьИспользование метода прямого окисления этилена в мировой промышленности
правитьВпервые метод прямого окисления этилена кислородом в присутствии серебряного катализатора был запатентован Лефортом в 1931 году. В дальнейшем этот метод изучался, неоднократно модифицировался и получал различные вариации для промышленного использования. Известно, как минимум четыре наиболее распространённые разработки[68], которые легли в основу современных коммерчески эффективных решений[69]:
- Разработчик: Union Carbide Corp.[71]
- Первая компания, реализовавшая промышленный метод прямого окисления этилена. Начиная с 1994 года, использует так называемый The METEOR[72] process, характеризующийся высокой производительностью, низкими начальными капитальными вложениями одновременно с низкими операционными затратами. Метод является исключительной собственностью компании и используется только на её собственных заводах (около 20 % всех мировых мощностей)[70].
- Разработчик: Scientific Design Co., Inc.
- Метод близкий к предыдущему, но широко распространённый в мире из-за системы лицензирования (с 1983 года реализовано около 90 проектов; около 25 % всех мировых мощностей и 75 % всех лицензионных производств окиси этилена)[70][73].
- Разработчик: Shell International Chemicals B.V.
- Метод отличает высокая гибкость в отношении специфических требований конкретных производств, повышенная селективность в отношении выхода окиси этилена, а также долгое время жизни катализатора (3 года). Занимает около 40 % всех мировых мощностей по производству этиленоксида[70].
- Разработчик: Japan Catalytic Chemical Co.
- Лицензионный метод, близкий методу Scientific Design, но адаптированный к организации единого производственного комплекса, предполагающего совмещение производства окиси этилена и этиленгликолей.
Как правило, на более старых предприятиях используются схемы производства окиси этилена, где в качестве окислителя выступает воздух (Union Carbide, Scientific Design). На современных производствах для окисления используют кислород (Union Carbide — Meteor process, Shell, Scientific Design — вторая версия, Japan Catalytic)[74].
Химия и кинетика процесса прямого окисления этилена
правитьФормально процесс прямого окисления этилена в присутствии серебряного катализатора можно записать в виде уравнения:
Вместе с тем, изучая практический процесс проведения реакции, можно наблюдать значительное количество углекислого газа и воды в её продуктах, что можно было бы объяснить полным окислением этилена или окиси этилена:
Механизм реакции прямого окисления этилена широко изучался, однако по настоящий момент не существует общепринятого мнения научного сообщества по этому вопросу.
В 1970-х годах процесс гетерогенного каталитического окисления этилена был изучен и описан P. A. Kilty и W. M. H. Sachtler, которые предположили для него следующий механизм[75]:
Здесь (ads) — частицы, адсорбированные на поверхности катализатора; (adj) — частицы серебра, непосредственно граничащие с атомами кислорода.
Общая схема реакции будет выглядеть следующим образом:
Таким образом была определена максимальная степень конверсии этилена в окись этилена: 6/7 или 85,7 %[75].
Данный механизм согласовывался с исследованиями W.Herzog, который использовал в качестве окислителя оксид азота (I)[75]:
Более поздние исследования механизма окисления этилена с использованием серебряного катализатора показали, что данный механизм не вполне корректен, а процесс образования окиси этилена начинается только после активации металла кислородом и внедрения молекул кислорода внутрь поверхности катализатора. Именно этот активный подповерхностный кислород и вступает в дальнейшую реакцию с этиленом, позволяя совершать селективное окисление[76], позволяющее довести теоретическую конверсию этилена в эпоксид до 100 % [77].
Поиск катализатора для проведения реакции селективного окисления этилена, успешно осуществлённый в 1930-х годах, привёл к металлическому серебру, осаждённому на различных носителях (пемза, силикагель, различные силикаты и алюмосиликаты, оксид алюминия, карбид кремния и пр.) и активированного специальными добавками (сурьма, висмут, пероксид бария и пр.)[78]. Эксперимент показал, что оптимальными условиями для проведения реакции является температура 220—280 °C (более низкая температура делает катализатор малоактивным, а более высокая уменьшает селективность реакции за счёт более глубокого окисления этилена) и давление 1—3 МПа (увеличивает производительность катализатора и облегчает абсорбцию окиси этилена из реакционных газов)[78].
Несмотря на существование единого фундаментального химического процесса каталитического окисления этилена, на практике существуют две различные технологические схемы окисления: более старая, предполагающая использование воздуха, и новая с использованием кислорода (>95 %).
Сравнительный анализ двух схем представлен в нижеследующей таблице[10]:
| Параметры | Окисление воздухом | Окисление кислородом |
|---|---|---|
| Содержание этилена в газовой смеси, % молярных | 2—10 | 20—35 |
| Температура процесса, °C | 220—277 | 220—235 |
| Рабочее давление, МПа | 1—3 | 2—3 |
| Конверсия (по этилену), % | 20—65 | 8—12 |
| Фактический выход окиси этилена, % молярных | 63—75 | 75—82 |
Помимо общеэкономических соображений, преимущество окисления этилена кислородом заключается в следующем[79]:
- процессы, использующие высокое давление, имеют меньшие издержки по сжатию кислорода по сравнению с воздухом;
- каталитические процессы с низкой конверсией по кислороду являются более дорогими в случае использования воздуха из-за необходимости удаления азота во время рециркуляции реакционной газовой смеси;
- процессы, в результате которых образуются опасные химические вещества, более управляемы в случае использования кислорода;
- более простое разделение продуктов реакции из-за отсутствия необходимости отделения азота;
- более быстрое и эффективное протекание реакции из-за отсутствия эффекта разбавления.
Мировое производство окиси этилена
правитьОксид этилена является одним из крупнейших по объёму органических полупродуктов мирового химического производства, уступая по данным на 2008 год лишь этилену (113 млн тонн в 2008 году[80]), пропилену (73 млн тонн в 2008 году[81]), этанолу (52 млн тонн в 2008 году[82]), бензолу (41 млн тонн в 2008 году[83]), метанолу (40 млн тонн в 2008 году[84]), терефталевой кислоте (39 млн тонн в 2008 году[85]), винилхлориду (36,7 млн тонн в 2008 году[86]), дихлорэтану (36,6 млн тонн в 2008 году[87]), этилбензолу (29,2 млн тонн в 2008 году[88]), п-ксилолу (28 млн тонн в 2008 году[89]), стиролу (26 млн тонн в 2008 году[90]), н-бутилену (21 млн тонн в 2008 году[91]) и толуолу (20 млн тонн в 2008 году[92]).
Производство окиси этилена является вторым после полиэтилена по значимости направлением использования этилена как важнейшего химического сырья и составляет 14,6 % его мирового потребления (по данным на 2008 год)[93].
Мировое производство окиси этилена в 2012 году составило 21 млн тонн (в 2010 году — 19,5 млн тонн, 2008 году — 19 млн тонн, 2007 году — 18 млн тонн), что составляет около 90 % всех мировых производственных мощностей (в 2007 году — 93 %)[94][95]. По прогнозным данным компании Merchant Research and Consulting Ltd. Архивная копия от 16 августа 2014 на Wayback Machine к 2016 году потребление окиси этилена вырастет до 24,2 млн тонн[94].
По состоянию на 2004 год мировое производство окиси этилена по регионам выглядит следующим образом[96]:
| Регион | Число производителей | Производство, тыс. тонн |
|---|---|---|
| Северная Америка США Канада Мексика |
10 3 3 |
4009 1084 350 |
| Южная Америка Бразилия Венесуэла |
2 1 |
312 82 |
| Европа Бельгия Франция Германия Нидерланды Испания Турция Великобритания Восточная Европа |
2 1 4 2 1 1 1 нет данных |
770 215 995 460 100 115 300 950 |
| Ближний Восток Иран Кувейт Саудовская Аравия |
2 1 2 |
201 350 1781 |
| Азия Китай Тайвань Индия Индонезия Япония Малайзия Южная Корея Сингапур |
нет данных 4 >2 1 4 1 3 1 |
1354 820 488 175 949 385 740 80 |
Крупнейшие мировые производители окиси этилена по объёму производственных мощностей, по состоянию на 2006 год (№ 1, 2, 5, 6), 2008—2009 гг. (№ 3, 4, 7):
- Dow Chemical Company: 3000—3500 тыс. тонн[97];
- SABIC (Saudi Basic Industries Corp.): 2000—2500 тыс. тонн[97];
- Shell: 1328 тыс. тонн[98][99][100][101][102];
- BASF: 1175 тыс. тонн[103];
- Китайская нефтехимическая корпорация: ~ 1000 тыс. тонн[97];
- Formosa Plastics[англ.]: 800—1000 тыс. тонн[97];
- Ineos: 920 тыс. тонн[104].
По данным на 2013 год 39 % мирового производства окиси этилена приходится на Азию, а 45 % сосредоточено в трёх странах — США, Китае и Саудовской Аравии[94].
По состоянию на 2013 год крупнейшими мировыми производителями окиси этилена являются компании Shell, Dow Chemical Company, SINOPEC Corp., Honam Petrochemical Corp, Ineos Oxide, Nan Ya Plastics Corp, Yanbu National Petrochemical Co, Saudi Kayan Petrochemical Company, MEGlobal и Shanghai Petrochemical[94].
Производителями окиси этилена, входящими в европейскую «Ассоциацию производителей окиси этилена и производных» (англ. Ethylene Oxide & Derivatives Producers Association)[105], являются компании: Akzo Nobel Functional Chemical, BASF, Clariant, Dow Europe, Ineos Oxide, La Seda de Barcelona, Lukoil Neftochim, ME Global, Sabic, Sasol Germany, Shell Chemicals[106].
Производство окиси этилена в России
правитьПроизводство окиси этилена в России осуществляется на следующих предприятиях:
- ПАО «Нижнекамскнефтехим» (г. Нижнекамск, Республика Татарстан)[107];
- Проектная мощность на 2008 год: 320 тыс. тонн/год.
- Объём производства в 2008 году: 248,8 тыс. тонн[108].
- АО «Сибур-Нефтехим»[109] (Завод окиси этилена и гликолей, г. Дзержинск, Нижегородская область)[110];
- Проектная мощность на 2008 год: 240 тыс. тонн/год.
- Объём производства в 2008 году: 239 тыс. тонн, в том числе товарной окиси этилена 80,4 тыс. тонн[111].
- ОАО «Казаньоргсинтез» (Завод «Оргпродукты», г. Казань, Республика Татарстан)[112];
- Проектная мощность на 2008 год: 60 тыс. тонн/год[113].
- Объём производства в 2008 году: 44 тыс. тонн.
Общий объём производства окиси этилена в России в 2008 году составил 531,7 тыс. тонн, что на 2 % ниже показателя 2007 года[111].
Производство окиси этилена в России осуществляется в соответствии с ГОСТ 7568-88[114].
Применение
правитьОсновным направлением использования окиси этилена является получение этиленгликолей[115]: до 75 % всего глобального потребления. Среди других ключевых производных можно выделить этоксилаты, этаноламины, простые и сложные эфиры этиленгликоля, полиэтиленгликоль.
Промышленное производство на основе окиси этилена
правитьОсновные направления промышленного использования
правитьОкись этилена — важнейшее сырьё, используемое в производстве крупнотоннажной химической продукции, являющейся основой для большого числа разнообразных товаров народного потребления во всех промышленно развитых странах.
Основные направления использования окиси этилена[116]:
- этиленгликоли — используются в качестве антифризов, в производстве полиэстера, полиэтилентерефталата (ПЭТ — сырьё для пластиковых бутылок), агентов для осушения газов, жидких теплоносителей, растворителей и пр.;
- полиэтиленгликоли — используются в производстве парфюмерии и косметики, фармацевтических препаратов, лубрикантов, растворителей для красок и пластификаторов;
- эфиры этиленгликоля — входят в состав тормозных жидкостей, моющих средств, растворителей лаков и красок;
- этаноламины — применяются в производстве мыла и моющих средств, очистки природного газа и аппретирования тканей;
- этоксилаты[117] — используют в производстве моющих средств, в качестве сурфактантов, эмульгаторов и диспергаторов.
Крупнейшим направлением использования окиси этилена является производство этиленгликолей, однако процент его применения в этом виде сильно варьирует в зависимости от региона: от 44 % в Западной Европе, 63 % Японии и 73 % в Северной Америке до 90 % в остальной части Азии и 99 % в Африке[118].
Производство этиленгликоля
правитьВ промышленности этиленгликоль получают некаталитической гидратацией окиси этилена при температуре до 200 °C и давлении 1,5—2 МПа[119]:
Побочными продуктами реакции будут диэтиленгликоль, триэтиленгликоль и полигликоли (суммарно около 10 %), которые отделяются от этиленгликоля дистилляцией при пониженном давлении[120].
Другой метод: реакция окиси этилена и CO2 с промежуточным получением этиленкарбоната (температура 80—120 °C и давление 2—5 МПа) и его последующий гидролиз с декарбоксилированием[119]:
В настоящий момент самыми современными технологиями производства этиленгликоля в мире являются[121]:
- Shell OMEGA® (Only MEG Advanced) technology[122] — двухступенчатый синтез через этиленкарбонат с использованием галогенида фосфония в качестве катализатора. Выход моноэтиленгликоля составляет 99—99,5 %; при этом примеси других гликолей практически отсутствуют. Главное достоинство процесса — получение этиленгликоля высокой чистоты без необходимости дальнейшей очистки.
- Dow METEOR® (Most Effective Technology for Ethylene Oxide Reactions) technology — комплексная технология получения окиси этилена и его последующего гидролиза в этиленгликоль. Выход моноэтиленгликоля составляет 90—93 %. Главное достоинство процесса — упрощённая структура производства, предполагающая меньшее число стадий и количество оборудования.
Производство эфиров гликолей
правитьОсновными эфирами моно-, ди- и триэтиленгликолей, производимыми в промышленных объёмах, являются метиловый, этиловый и нормальный бутиловый, а также их ацетаты и фталаты[123].
Химическая схема производства заключается в реакции соответствующего спирта с окисью этилена:
Реакция моноэфиров с кислотой или её ангидридом приводит к образованию соответствующих сложных эфиров:
Производство этаноламинов
правитьВ промышленности этаноламины (моно-, ди- и триэтаноламины) получают по реакции аммиака с окисью этилена в безводной среде при температуре 40—70 °C, давлении 1,5—3,5 МПа[124]:
В процессе реакции образуются все три этаноламина, при этом аммиак и часть моноэтаноламина подвергаются рециркуляции. Разделение готовых продуктов осуществляется с помощью вакуумной дистилляции.
Аналогично получают и различные гидроксиалкиламины:
Монозамещённые продукты образуются при действии на большой избыток амина окиси этилена в присутствии воды и температуре менее 100 °C; дизамещённые — при небольшом избытке окиси этилена, температуре 120—140 °C и давлении 0,3—0,5 МПа[125].
Производство этоксилатов
правитьПроизводство этоксилатов в промышленности осуществляют прямой реакцией высших спиртов, кислот или аминов с окисью этилена в присутствии щелочного катализатора при температуре 120—180 °C.
В настоящий момент в промышленности новые мощности по выпуску этоксилатов обычно основаны на The BUSS LOOP® reactors technology[126].
The BUSS LOOP® reactors technology представляет собой непрерывный процесс, включающий в себя три стадии[127]:
- предварительная подготовка: инициатор или катализатор реакции вместе с исходным сырьём подаются в ёмкость, где происходит его предварительная обработка — смешение, нагрев и вакуумное обезвоживание в соответствии с технологией;
- химическая реакция: осуществляется в специальном изолированном реакторе в инертной атмосфере (азот) для предотвращения возможного взрыва окиси этилена;
- завершающая стадия: нейтрализация реакционной смеси, дегазация и очистка товарной продукции.
Производство акрилонитрила
правитьВ настоящий момент производство акрилонитрила производится преимущественно (90 % по состоянию на 2008 год) SOHIO-методом[128], однако вплоть до 1960 года одним из важнейших производственных процессов его получения был метод присоединения цианистого водорода к окиси этилена с последующей дегидратацией образующегося циангидрина[129][130]:
Присоединение синильной кислоты к окиси этилена осуществляется в присутствии катализатора (гидроксид натрия и диэтиламин), а дегидратация циангидрина происходит в газовой фазе при каталитическом воздействии активного оксида алюминия[131].
Прочие направления использования
правитьПрямое использование окиси этилена в различных отраслях экономики, по состоянию на 2004 год, составляет всего 0,05 % всего мирового объёма производства[96].
Этиленоксид используется как фумигант и дезинфицирующее вещество в смеси с диоксидом углерода (8,5—80 % окиси этилена), азотом или дихлордифторметаном (12 % окиси этилена) для газовой стерилизации медицинского оборудования и инструмента, шприцев, упаковочных материалов и спецодежды, лекарственных форм, хирургического и научного оборудования[96]; обработки мест хранения различных растительных продуктов (табак, упаковки с зерном, мешки с рисом и т. п.), одежды и меха, ценных документов[132].
Кроме того, окись этилена применяется в качестве ускорителя созревания листьев табака и фунгицида в сельском хозяйстве[132].
Специфическим направлением использования окиси этилена является её возможность применения в качестве основного компонента боеприпасов объёмного взрыва[133].
Идентификация окиси этилена
правитьПростейшей качественной реакцией может служить свойство окиси этилена осаждать нерастворимые гидроксиды металлов при её пропускании через водные растворы солей, например:
По аналогии, пропуская воздух через водный раствор некоторых солей натрия или калия (хлориды, иодиды, неорганические тиосульфаты и др.) с добавлением фенолфталеина, окись этилена обнаруживается по появлению ярко-розовой окраски индикатора[134]:
Существует множество других методов идентификации окиси этилена в присутствии различных сопутствующих веществ, среди которых можно упомянуть[134]:
- цветные реакции с производными пиридина;
- реакция образующегося при гидролизе этиленгликоля с иодной кислотой — образующаяся иодноватая кислота определяется с помощью нитрата серебра.
Основным физическим методом определения окиси этилена в различных средах является газовая хроматография[96].
Огне- и пожароопасность
правитьВещество является чрезвычайно огнеопасным, его смеси с воздухом взрывоопасны. При нагревании из-за бурного разложения существует риск пожара и взрыва[135].
Температура самовоспламенения составляет 429 °C; минимальное огнеопасное содержание в воздухе: 2,7 % об.[136]
Для тушения огня, вызванного возгоранием окиси этилена, используются традиционные средства пожаротушения, включая пену, углекислый газ и воду. Борьба с горящей окисью этилена затруднена, так как в определённых условиях он может продолжать гореть и в инертной атмосфере, а также в виде водного раствора — для гарантированного гашения огня необходимо разбавление водой в отношении не менее чем 22:1[137].
Физиологическое воздействие
правитьДействие на микроорганизмы
правитьОкись этилена подавляет развитие микроорганизмов (дезинфицирующие свойства), а в достаточной концентрации их полностью уничтожает. Сильные алкилирующие свойства делают этиленоксид универсальным ядом для протоплазмы:[140] вещество вызывает свёртывание белка, дезактивацию ферментов и других биологически важных компонентов живого организма[141][142]
Против бактерий (особенно — грамположительных) окись этилена действует сильнее, чем против дрожжей и плесеней[141].
Дезинфицирующее действие окиси этилена по своему эффекту схоже с температурной стерилизацией, с тем различием, что окись этилена воздействует на объекты преимущественно поверхностно из-за её ограниченной проникающей способности.
Уровень стерильности (The Sterility Assurance Level, SAL) после воздействия окиси этилена составляет 10−6[143], то есть шанс обнаружения бактерии составляет не более, чем один на миллион[144][145]
Действие на человека и животных
правитьОкись этилена — алкилирующий агент; обладает раздражающим, сенсибилизирующим и наркотическим действием[146]. Хроническое воздействие окиси этилена обладает мутагенным эффектом; IARC относит окись этилена к группе 1, считая доказанной его канцерогенность для человека[147].
При концентрациях в воздухе около 200 частей на миллион оказывает раздражающий эффект на слизистые оболочки носа и горла; более высокое содержание вызывает поражение трахеи и бронхов, а также частичный коллапс лёгких. Высокие концентрации могут вызвать отёк лёгких и поражение сердечно-сосудистой системы, при этом поражающий эффект окиси этилена может проявиться только спустя 72 часов с момента отравления[17].
Этиленоксид вызывает острое отравление, сопровождающееся следующими симптомами: лёгкое сердцебиение, подёргивание мышц, покраснение лица, головные боли, нистагм, понижение слуха и ацидоз, рвота, головокружение, кратковременная потеря сознания, сладкий привкус во рту. При острой интоксикации: сильная пульсирующая головная боль, головокружение, неуверенность при ходьбе, затруднение речи, расстройство сна, боль в ногах, вялость, скованность, потливость, повышенная мышечная возбудимость, преходящий спазм сосудов сетчатки, увеличение печени и нарушение её антитоксической функции[146].
Этиленоксид обладает сильной резорбционной способностью, легко проникая через одежду и обувь, вызывая раздражение кожи, дерматит с образованием пузырей, повышением температуры и лейкоцитозом[146][148]
Значения средних летальных доз окиси этилена в отношении некоторых животных:
Гигиенические нормативы
правитьОсновные российские гигиенические нормативы для окиси этилена[150]:
- ПДК в воздухе рабочей зоны производственных помещений составляет 1 мг/м³ (рекомендуемое);
- класс опасности для рабочей зоны: 2 (высокоопасное химическое вещество);
- особенность токсического действия на организм: К (канцероген);
- ПДК максимально разовая в атмосферном воздухе населённых мест = 0,3 мг/м³;
- ПДК среднесуточная в атмосферном воздухе населённых мест = 0,03 мг/м³;
- класс опасности для населённых пунктов: 3 (умеренно опасное);
- лимитирующий показатель воздействия: рефлекторно-резорбтивный.
Предельное содержание окиси этилена в атмосферном воздухе по нормативам США (American Conference of Governmental and Industrial Hygienists): 1,8 мг/м³[151]
Примечания
править- ↑ Таблица органических соединений. Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalitica.com (31 марта 2009). Дата обращения: 21 сентября 2009. Архивировано 22 августа 2014 года.
- ↑ 1 2 Этилена окись // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ 1 2 3 4 5 6 7 Этиленоксид // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 5. — С. 990—991.
- ↑ 1 2 3 4 Термодинамические показатели органических соединений. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0275.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Wurtz A. (фр.) // Comptes rendus de l’Académie des sciences. — 1859. — No 48. — P. 101—104.
- ↑ Её значение у Вюрца оказалось несколько выше измеренного в современных условиях: 13,5 °C
- ↑ 1 2 3 Часть I. Строение и свойства окиси этилена. Особенности реакционной способности окиси этилена и строение её молекулы // Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — С. 15—17.
- ↑ 1 2 3 4 5 Ethylene Oxide // Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems. — 4th ed. — New York: John Wiley & Sons, 1994. — P. 450—466.
- ↑ Lefort T. E. Process for the production of ethylene oxide. United States Patent 1998878 (англ.) (pdf). FreePatentsOnline (23 апреля 1935). Дата обращения: 23 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Напряжение молекул // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 3. — С. 330—334.
- ↑ 1 2 Травень В. Ф. Органическая химия: Учебник для вузов: В 2 т / В. Ф. Травень. — М.: ИКЦ «Академкнига», 2004. — Т. 2. — С. 102—106. — ISBN 5-94628-172-0.
- ↑ Cunningham G. L., Levan W. I., Gwinn W. D. The Rotational Spectrum of Ethylene Oxide (англ.) // Phys. Rev. — 1948. — Vol. 74. — P. 1537.
- ↑ Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону / Отв. редактор В. Н. Кондратьев. — М.: Наука, 1974. — С. 77—78.
- ↑ Динамическая вязкость жидкой окиси этилена при 0 °C примерно в 5,5 раз ниже, чем у воды при той же температуре.
- ↑ 1 2 Medical Management Guidelines for Ethylene Oxide (англ.). Medical Management Guidelines (MMGs). Agency for Toxic Substances and Disease Registry. Дата обращения: 29 сентября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Поверхностное натяжение сжиженных газов на границе с собственным паром. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ Температуры кипения или возгонки (°C) органических веществ при давлении пара выше 101,3 кПа. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ Вязкость органических соединений. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ Давление пара органических соединений. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ Дипольные моменты некоторых веществ. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ Здесь и далее «н/д» — нет данных.
- ↑ Обычно используется сильно разбавленная серная кислота.
- ↑ 1 2 3 4 5 Глава III. Обзор отдельных реакций окиси этилена // Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — С. 90—120.
- ↑ Epoxyethane (Ethylene Oxide) (англ.). Alkenes menu. Chemguide. Дата обращения: 5 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Nonionic surfactants: organic chemistry / Editor(s): Nico M. van Os. — CRC Press, 1998. — P. 129—131. — ISBN 978-0-824-79997-7.
- ↑ Реакции способствует добавление небольшого количества воды.
- ↑ Петров А. А., Бальян Х. В., Трощенко А. Т. Глава 12. Аминоспирты // Органическая химия: Учебник для вузов / Под ред. М. Д. Стадничука. — 5-е изд., перераб. и доп. — СПб.: Иван Фёдоров, 2002. — С. 286. — ISBN 5-81940-067-4.
- ↑ Бромоводород и йодоводород реагируют с окисью этилена более энергично, чем хлористый водород.
- ↑ При полном отсутствии воды окись этилена полимеризуется.
- ↑ Шеппард У., Шартс К. Органическая химия фтора = Organic Fluorine Chemistry / Под ред. академика И. Л. Кнунянца. — М.: Мир, 1972. — С. 98.
- ↑ Ethylene cyanohydrin (англ.) (pdf). Organic Syntheses, Coll. Vol. 1, p.256 (1941). Organic Syntheses. Дата обращения: 3 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ 2-Nitroethanol (англ.) (pdf). Organic Syntheses, Coll. Vol. 5, p.833 (1973). Organic Syntheses. Дата обращения: 2 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ: Учебник для вузов. — Издание 3-е, переработанное. — Л.: Химия, 1981. — С. 278.
- ↑ Vogel A. I. Vogel’s Textbook of Practical Organic Chemistry / Rev. by Furniss B. S., Hannaford A. J., Smith P. W. G., Tatchell A. R.. — 5th ed. — UK: Longman Scientific & Technical, 1989. — P. 1088. — ISBN 0-582-46236-3.
- ↑ United States Patent 4443643. Reaction of benzene with ethylene oxide to produce styrene (англ.) (pdf). FreePatentsOnline. Дата обращения: 13 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Хираока М. Краун-соединения. Свойства и применение = Crown Compounds. Their Characteristics and Applications / Пер. с англ. — М.: Мир, 1986. — С. 33—34.
- ↑ Roesky H. W., Schmidt H. G. Reaction of Ethylene Oxide with Sulfur Dioxide in the Presence of Cesium Ions: Synthesis of 1,3,6,9,2λ4-Tetraoxathia-2-cycloundecanone (англ.) // Angewandte Chemie : International Edition in English. — 1985. — Vol. 24, no. 8. — P. 695.
- ↑ Петров А. А., Бальян Х. В., Трощенко А. Т. Глава 4. Простые эфиры // Органическая химия: Учебник для вузов / Под ред. М. Д. Стадничука. — 5-е изд., перераб. и доп. — СПб.: Иван Фёдоров, 2002. — С. 159—160. — ISBN 5-81940-067-4.
- ↑ 1 2 Benson S. W. Pyrolysis of Ethylene Oxide. A Hot Molecule Reaction (англ.) // The Journal of Chemical Physics. — 1964. — Vol. 40, no. 1. — P. 105. (недоступная ссылка)
- ↑ В схеме [3] M — стенка реакционного сосуда или гетерогенного катализатора.
- ↑ 1 2 3 4 Глава II. Химические свойства окиси этилена // Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — С. 57—85.
- ↑ 1 2 3 Hudlický M. Reductions in Organic Chemistry. — Chichester: Ellis Horwood Limited, 1984. — P. 83. — ISBN 0-85312-345-4.
- ↑ Восстанавливающим агентов является хлорид титана (II), образующийся по реакции алюмогидрида лития с хлоридом титана (III).
- ↑ Dagaut P., Voisin D., Cathonnet M., McGuinness M., Simmie J. M. The oxidation of ethylene oxide in a jet-stirred reactor and its ignition in shock waves (англ.) // Combustion and Flame. — 1996. — Vol. 156, no. 11. — P. 62—68.
- ↑ United States Patent 3998848. Cyclodimerization of ethylene oxide (англ.) (pdf). FreePatentsOnline. Дата обращения: 11 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 Дымент О. Н., Казанский К. С., Мирошников А. М. Гликоли и другие производные окисей этилена и пропилена / Под ред. О. Н. Дымента. — М.: Химия, 1976. — С. 214—217.
- ↑ 1 2 Polymeric materials encyclopedia / Editor-in-chief Joseph C. Salamone. — CRC Press, Inc, 1996. — P. 6036—6037. — ISBN 978-0-849-32470-3.
- ↑ Neufeld L. M., Blades A. T. The Kinetics of the Thermal Reactions of Ethylene Oxide (англ.) // Canadian Journal of Chemistry. — 1963. — Vol. 41. — P. 2956.
- ↑ 1 2 Lifshitz A., Ben-Hamou H. Thermal reactions of cyclic ethers at high temperatures. 1. Pyrolysis of ethylene oxide behind reflected shocks (англ.) // The Journal of Physical Chemistry. — 1983. — Vol. 87. — P. 1782.
- ↑ Джилкрист Т. Химия гетероциклических соединений = Heterocyclic Chemistry / Под ред. д. х. н. М. А. Юровской. — М.: Мир, 1996. — С. 411—412. — ISBN 5-03-003103-0.
- ↑ 1 2 Марч Дж. Органическая химия. Реакции, механизмы и структура. Углублённый курс для университетов и химических вузов: в 4 томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под ред. И. П. Белецкой. — М.: Мир, 1987. — Т. 2. — С. 171.
- ↑ Физер Л., Физер М. Реагенты для органического синтеза = Reagents for Organic Synthesis / Под ред. академика И. Л. Кнунянца. — М.: Мир, 1978. — Т. 7. — С. 545.
- ↑ Шелдон Р. А. Химические продукты на основе синтез-газа // = Chemicals from Synthesis Gas / Пер. с англ./Под ред. С. М. Локтева. — М.: Химия, 1987. — С. 219.
- ↑ 1 2 Физер Л., Физер М. Реагенты для органического синтеза = Reagents for Organic Synthesis / Под ред. академика И. Л. Кнунянца. — М.: Мир, 1975. — Т. 6. — С. 197.
- ↑ United States Patent 20030032845. Hydroformylation of ethylene oxide (англ.) (pdf). FreePatentsOnline. Дата обращения: 11 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Глава V. Получение окиси этилена через этиленхлоргидрин // Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — С. 155—182.
- ↑ 1 2 3 4 Часть II. Получение окиси этилена. Обзор реакций образования окиси этилена и других α-окисей // Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — С. 145—153.
- ↑ McMurry J. Organic chemistry. — 7th ed. — Thomson, 2008. — P. 661. — ISBN 0-495-11258-5.
- ↑ Lippits M.J., Nieuwenhuysa B.E. Direct conversion of ethanol into ethylene oxide on copper and silver nanoparticles: Effect of addition of CeOx and Li2O // Catalysis Today. — Available online, 2010. — № 24 April 2010.
- ↑ Norris J. F. The Manufacture of War Gases in Germany (англ.) // Journal of Industrial and Engineering Chemistry. — 1919. — Vol. 11. — P. 817.
- ↑ 1 2 Weissermel K., Arpe H.-J. Industrial organic chemistry. — 4th ed. — Weinheim: Wiley-VCH, 2003. — P. 145—148. — ISBN 978-3-527-30578-0.
- ↑ 1 2 Введение // Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — С. 10—11.
- ↑ Слинько М. Г. Краткая история промышленных каталитических процессов // Вестник Российской академии наук. — 2001. — Т. 71, № 7. — С. 635.
- ↑ Process Economics Program Report 2D (англ.). Process Economics Program. SRI Consulting (февраль 1985). Дата обращения: 19 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 4 Юкельсон И. И. Технология основного органического синтеза. — М.: Химия, 1968. — С. 554—559.
- ↑ Все методы используют принципиально один и тот же, с точки зрения химии процесс окисления этилена кислородом или воздухом, а также катализатор на основе серебра, но различаются организацией технологического процесса, технологическими режимами и решениями, а также аппаратным исполнением.
- ↑ Catalitic Oxidation of Olefins // Advances in catalysis and related subjects / Edited by D. D. Eley, H. Pines, P. B. Weisz. — New York: Academic Press Inc, 1967. — P. 156—157.
- ↑ 1 2 3 4 Bloch H. P., Godse A. Compressors and modern process applications. — John Wiley and Sons, 2006. — P. 295—296. — ISBN 978-0-471-72792-7.
- ↑ В настоящий момент компания является подразделением The Dow Chemical Co. Архивная копия от 25 февраля 2011 на Wayback Machine
- ↑ Расшифровка аббревиатуры: Most Effective Technology for Ethylene Oxide Reactions
- ↑ Ethylene Oxide/Ethylene Glycol Process (англ.). Process Licensing and Engineering. Scientific Design Company. Дата обращения: 3 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Chauvel A., Lefebvre G. Petrochemical processes 2. Major Oxygenated, Chlorinated and Nitrated Derivatives. — 2nd ed. — Paris: Editions Technip, 1989. — P. 4. — ISBN 2-7108-0563-4.
- ↑ 1 2 3 Kilty P. A., Sachtler W. M. H. The mechanism of the selective oxidation of ethylene to ethylene oxide (англ.) // Catalysis Reviews: Science and Engineering. — 1974. — Vol. 10, no. 1. — P. 1—16.
- ↑ Rigas N. C., Svoboda G. D., Gleave J. T. Activation of Silver Powder for Ethylene Epoxidation at Vacuum and Atmospheric Pressures (англ.) // ACS Symposium Series. — 1993. — Vol. 523, no. 14. — P. 183—203.
- ↑ Kobayashi H., Nakashiro K., Iwakura T. Density Functional Study of Ethylene Oxidation on Ag(111) Surface. Mechanism of Ethylene–Oxide Formation and Complete Oxidation with Influence of Subsurface Oxygen (англ.) // Internet Electronic Journal of Molecular Design. — 2002. — Vol. 1, no. 12. — P. 620—635. Архивировано 31 января 2016 года.
- ↑ 1 2 Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. и доп. — М.: Химия, 1988. — С. 420—424. — ISBN 5-7245-0008-6.
- ↑ Gunardson H. Industrial gases in petrochemical processing. — New York: Marcel Dekker, Inc., 1998. — P. 131—132. — ISBN 0-8247-9908-9.
- ↑ Ethylene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Propylene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Statistic (англ.). Renewable Fuels Association. Дата обращения: 12 октября 2009. Архивировано из оригинала 24 октября 2005 года.
- ↑ Benzene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Methanol (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Terephthalic Acid (TPA) (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Vinyl Chloride Monomer (VCM) (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Ethylene Dichloride (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Ethylbenzene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ p-Xylene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Styrene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Butylenes (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Toluene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Ethylene (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 5 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 4 Global Ethylene Oxide Supply to Amount to 24.2 Mln Tonnes in 2016, According to New Report by Merchant Research & Consulting (англ.). PRWeb (январь 2014). Дата обращения: 13 августа 2014. Архивировано 18 апреля 2016 года.
- ↑ Ethylene Oxide (англ.). World Petrochemicals. SRI Consulting (январь 2009). Дата обращения: 29 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 4 5 [https://archive.org/details/13butadieneethyl0097iarc 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide)]. — IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97. — Lyon: International Agency for Research on Cancer, 2008. — P. 185—287. — ISBN 978-92-832-1297-3.
- ↑ 1 2 3 4 Devanney M. T. Ethylene Oxide (англ.). Chemical Economics Handbook. SRI Consulting (апрель 2007). Дата обращения: 19 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Ethylene Glycols (Singapore) Pte Ltd, Singapore (англ.). Manufacturing locations. Shell Chemicals. Дата обращения: 12 октября 2009. Архивировано из оригинала 30 марта 2009 года.
- ↑ Overview (англ.). About Us. Mitsubishi Chemical Corporation. Дата обращения: 12 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Shell Chemical LP — Geismar, United States of America (англ.). Manufacturing locations. Shell Chemicals. Дата обращения: 12 октября 2009. Архивировано из оригинала 30 марта 2009 года.
- ↑ Shell Nederland Chemie BV — Moerdijk, Netherlands (англ.). Manufacturing locations. Shell Chemicals. Дата обращения: 12 октября 2009. Архивировано из оригинала 30 марта 2009 года.
- ↑ Plants/Facilities and Capacity (англ.). CNOOC and Shell Petrochemicals Company Limited. Дата обращения: 12 октября 2009. (недоступная ссылка)
- ↑ Segment Chemicals — Products (англ.). BASF. Дата обращения: 12 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Ethylene Oxide (EO) (англ.). Ineos Oxide. Дата обращения: 12 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Входит в состав Association of Petrochemicals Producers in Europe.
- ↑ Ethylene oxide (англ.). Association of Petrochemicals Producers in Europe. Дата обращения: 8 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Официальный сайт предприятия http://www.nknh.ru/ Архивная копия от 25 сентября 2009 на Wayback Machine
- ↑ Нижнекамскнефтехим. Годовой отчёт — 2008. — ОАО «Нижнекамскнефтехим», 2009. — 88 с.
- ↑ Входит в состав ОАО «Сибур Холдинг».
- ↑ Официальный сайт предприятия http://www.sibur.ru/ Архивная копия от 13 марта 2016 на Wayback Machine
- ↑ 1 2 Годовой отчёт ОАО «Сибур-Нефтехим» за 2008 год. — ОАО «Сибур-Нефтехим», 2009. — 58 с. Архивировано 6 января 2012 года.
- ↑ Официальный сайт предприятия http://www.kazanorgsintez.ru/ Архивная копия от 3 октября 2009 на Wayback Machine
- ↑ История. ОАО «Казаньоргсинтез». Дата обращения: 14 октября 2009. Архивировано 21 августа 2011 года.
- ↑ ГОСТ 7568-88. Этилена окись. Технические условия. — Издание официальное. — М.: Государственный комитет СССР по стандартам, 1988. — 54 с.
- ↑ Включая диэтиленгликоль и триэтиленгликоль.
- ↑ Ethylene oxide product overview (англ.). Ethylene oxide. Shell Chemicals. Дата обращения: 8 октября 2009. Архивировано из оригинала 28 апреля 2009 года.
- ↑ Продукты взаимодействия окиси этилена с высшими спиртами, кислотами или аминами.
- ↑ Ethylene Oxide (EO) Uses and Market Data (англ.). Chemical Intelligence. Chemical Industry News & Intelligence (ICIS.com). Дата обращения: 8 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ 1 2 Этиленгликоль // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 5. — С. 984—985.
- ↑ Handbook of Detergents, Part F: Production / Edited by Uri Zoller, co-editor Paul Sosis. — CRC Press, 2008. — ISBN 978-0824-70349-3.
- ↑ Syed Naqvi. Process Economics Program Report 2I (англ.). Process Economics Program. SRI Consulting (сентябрь 2009). Дата обращения: 20 октября 2009. Архивировано 21 августа 2011 года.
- ↑ По данным компании Shell (недоступная ссылка) первое промышленное производство по методу Shell OMEGA® было открыто в 2008 году в Южной Корее.
- ↑ Encyclopedia of chemical processing and design / Edited by John J. McKetta, William A. Cunningham. — New York: Marcel Dekker, Inc, 1984. — P. 259—260. — ISBN 0-8247-2470-4.
- ↑ Технология производства этаноламинов. Технологии. Химтэк Инжиниринг. Дата обращения: 22 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Чекалин М. А., Пассет Б. В., Иоффе Б. А. Технология органических красителей и промежуточных продуктов: Учебное пособие для техникумов. — 2-е изд., перераб. — Л.: Химия, 1980. — С. 185.
- ↑ 1 2 Chemistry and technology of surfactants / Edited by R. J. Farn. — Blackwell Publishing, 2006. — P. 133. — ISBN 1-4051-2696-5.
- ↑ Alkoxylation (англ.). BUSS LOOP Reactor. Buss ChemTech AG. Дата обращения: 21 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Метод заключается в каталитическом окислении пропилена в присутствии аммиака на фосформолидате висмута.
- ↑ The Sohio Acrylonitrile Process (англ.). National Historic Chemical Landmarks. Дата обращения: 22 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ 13.1.3.5. Окислительный аммонолиз углеводородов. Новый справочник химика и технолога. Сырье и продукты промышленности органических и неорганических веществ (часть II). ChemAnalitica.com (1 апреля 2009). Дата обращения: 22 октября 2009. Архивировано 8 июля 2011 года.
- ↑ Андреас Ф., Грабе К. Химия и технология пропилена = Propylenchemie / Под ред. З. Н. Полякова. — Л.: Химия, 1973. — С. 117—118.
- ↑ 1 2 Ethylene oxide (англ.). Chemical Backgrounders Index. The Environment Writer. Дата обращения: 29 сентября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ United States Patent 4132170. Fuel-air type bomb (англ.) (pdf). FreePatentsOnline. Дата обращения: 22 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Глава IV. Методы анализа окиси этилена // Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — С. 128—140.
- ↑ Этилен оксид. ICSC / Международные карты Химической Безопасности. Институт промышленной безопасности, охраны труда и социального партнёрства. Дата обращения: 21 сентября 2009. Архивировано 28 декабря 2005 года.
- ↑ Ethylene Oxide (англ.). Health and Safety Guide. International Programme on Chemical Safety (IPCS) INCHEM (1988). Дата обращения: 23 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Ethylene Oxide. Material Safety Data Sheet (англ.) (pdf). Shell Chemicals. Дата обращения: 21 января 2012. Архивировано 23 января 2012 года.
- ↑ Informational Bulletin NFPA 2009-04N (англ.) (pdf). Department of Emergency Services, County of Sonoma (10 января 2009). Дата обращения: 21 января 2012. Архивировано 23 января 2012 года.
- ↑ Расшифровка обозначений:
- синий цвет — опасность для здоровья;
- красный цвет — пожароопасность;
- жёлтый цвет — химическая активность.
- ↑ Токсические свойства окиси этилена. Дата обращения: 16 января 2015. Архивировано из оригинала 17 января 2015 года.
- ↑ 1 2 Окись этилена. Консервирующие вещества. Консерванты в пищевой промышленности. Дата обращения: 25 сентября 2009. Архивировано из оригинала 23 июня 2009 года.
- ↑ Физиологические действия окиси этилена на биологические объекты. Дата обращения: 16 января 2015. Архивировано из оригинала 17 января 2015 года.
- ↑ Речь идёт о том, что подобный уровень стерильности достигается соответствующими методиками и временем воздействия на объект стерилизации.
- ↑ Conviser S. The Future of Ethylene Oxide Sterilization (англ.). ICT Magazine. Дата обращения: 23 октября 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ ГОСТ Р ИСО 11135. Дата обращения: 16 января 2015. Архивировано из оригинала 26 января 2016 года.
- ↑ 1 2 3 Вредные вещества. Раздел 4. Гетероциклические соединения. Трёхчленные гетероциклические соединения. Новый справочник химика и технолога. Вредные химические вещества. Радиоактивные вещества. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ Collins J. L. Эпоксидные соединения. Энциклопедия МОТ. Институт промышленной безопасности, охраны труда и социального партнёрства. Дата обращения: 25 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Аллергические реакции на окись этилена. Дата обращения: 16 января 2015. Архивировано из оригинала 17 января 2015 года.
- ↑ 1 2 Safety data for ethylene oxide (англ.). The Physical and Theoretical Chemistry Laboratory Oxford University. Дата обращения: 22 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Гигиенические нормативы (ПДК, ОБУВ, ОДУ) химических веществ в воздухе рабочей зоны, атмосферном воздухе населённых мест, воде водоёмов. Новый справочник химика и технолога. Вредные химические вещества. Радиоактивные вещества. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 20 августа 2014 года.
- ↑ Carson P. A., Mumford C. J. Hazardous Chemicals Handbooks. — Oxford: Butterworth-Heinemann Ltd, 1994. — P. 85. — ISBN 0-7506-0278-3.
Литература и прочие внешние источники
правитьМонографии
править- Дымент О. Н., Казанский К. С., Мирошников А. М. Гликоли и другие производные окисей этилена и пропилена / Под ред. О. Н. Дымента. — М.: Химия, 1976. — 376 с.
- Зимаков П. В. Окись этилена. — М.: Госхимиздат, 1946. — 240 с.
- Малиновский М. С. Окиси олефинов и их производные / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Госхимиздат, 1961. — 554 с.
- Окись этилена / Под ред. проф. П. В. Зимакова и к. т. н. О. Н. Дымента. — М.: Химия, 1967. — 320 с.
- Пакен А. М. Эпоксидные соединения и эпоксидные смолы / Пер. с нем. под ред. Л. С. Эфроса. — Л.: Госхимиздат, 1962. — 964 с.
- Bailey F. E., Koleske J. V. Alkylene oxides and their polymers. — New York: Marcel Dekker, Inc, 1991. — P. 261. — ISBN 0-8247-8384-0.
Физические свойства и молекулярная структура окиси этилена
править- Cunningham G. L., Jr., Boyd A. W., Myers R. J., Gwinn W. D., Le Van W. I. The Microwave Spectra, Structure, and Dipole Moments of Ethylene Oxide and Ethylene Sulfide (англ.) // J. Chem. Phys.. — 1951. — Vol. 19. — P. 676—685. (недоступная ссылка)
- Cunningham G. L., Levan W. I., Gwinn W. D. The Rotational Spectrum of Ethylene Oxide (англ.) // Phys. Rev.. — 1948. — Vol. 74. — P. 1537—1537.
- Ikeda M. et al. Survey Observations of c-C2H4O and CH3CHO toward Massive Star-forming Regions (англ.) // ApJ. — 2001. — Vol. 560. — P. 792—805.
- Lord R. C., Nolin B. Vibrational Spectra of Ethylene Oxide and Ethylene Oxide-d4 (англ.) // J. Chem. Phys.. — 1956. — Vol. 24. — P. 656—658. (недоступная ссылка)
- Nakanaga T. Infrared band intensities of ethylene oxide (англ.) // J. Chem. Phys.. — 1981. — Vol. 74. — P. 5384—5392. (недоступная ссылка)
- Pan J., Albert S., Sastry K. V. L. N., Herbst E., De Lucia F. C. The Millimeter- and Submillimeter-Wave Spectrum of Ethylene Oxide (c-C2H4O) (англ.) // ApJ. — 1998. — Vol. 499. — P. 517—519.
- Sutter D. H., Hüttner W., Flygare W. H. Molecular g Values, Magnetic Susceptibility Anisotropies, and Molecular Quadrupole Moments in Ethylene Oxide (англ.) // J. Chem. Phys.. — 1969. — Vol. 50. — P. 2869—2874. (недоступная ссылка)
Химия и промышленное производство окиси этилена
править- ГОСТ 7568-88. Этилена окись. Технические условия. — Издание официальное. — М.: Государственный комитет СССР по стандартам, 1988. — 54 с.
- Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. и доп. — М.: Химия, 1988. — 592 с. — ISBN 5-7245-0008-6.
- Юкельсон И. И. Технология основного органического синтеза. — М.: Химия, 1968. — С. 553—603.
- Benson S. W. Pyrolysis of Ethylene Oxide. A Hot Molecule Reaction (англ.) // The Journal of Chemical Physics. — 1964. — Vol. 40, no. 1. — P. 105—112. (недоступная ссылка)
- Bielański A., Habe J. Oxidation of Aliphatic Hydrocarbons // Oxygen in catalysis. — New York: Marcel Dekker, Inc, 1991. — P. 277—370. — ISBN 0-8247-8320-4.
- Chauvel A., Lefebvre G. Chapter 7. Ethylene and propylene oxides // Petrochemical processes 2. Major Oxygenated, Chlorinated and Nitrated Derivatives. — 2nd ed. — Paris: Editions Technip, 1989. — P. 1—68. — ISBN 2-7108-0563-4.
- Ethylene Oxide // Encyclopedia of chemical processing and design / Edited by John J. McKetta, William A. Cunningham. — New York: Marcel Dekker, Inc, 1984. — P. 274—318. — ISBN 0-8247-2470-4.
- Ethylene Oxide // Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems. — 4th ed. — New York: John Wiley & Sons, Inc, 1994. — P. 450—466.
- Wittcoff H., Reuben B. G., Plotkin J. S. Industrial organic chemicals. — 2nd ed. — New Jersey: John Wiley & Sons, Inc, 2004. — 662 p. — ISBN 0-471-44385-9.
Физиологическое воздействие окиси этилена
править- 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide). — IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97. — Lyon: International Agency for Research on Cancer, 2008. — 525 p. — ISBN 978-92-832-1297-3.
- Medical Management Guidelines for Ethylene Oxide (англ.). Agency for Toxic Substances and Disease Registry. Архивировано из оригинала 21 августа 2011 года.
- Toxicological profile for ethylene oxide. — Agency for Toxic Substances and Disease Registry U.S. Public Health Service, 1990.
- Toxicology and carcinogenesis studies of ethylene oxide (CAS NO. 75-21-8) in B6C3F1 mice (inhalation studies). — U.S. Department of Health and Human Services, 1987.
Прочее
править- Guidelines for the distribution of Ethylene Oxide. — 3rd rev. — Ethylene Oxide and Derivatives Sector Group, 2004. Архивная копия от 12 октября 2012 на Wayback Machine
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |