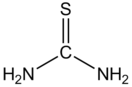
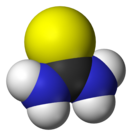
Тиомочевина — CS(NH2)2 — диамид тиоугольной кислоты, тиокарбамид, белые кристаллы горького вкуса и запахом жареного лука, tпл 180—182 °C (при быстром нагревании; при медленном — разлагается); умеренно растворима в воде, метаноле, пиридине, хорошо — в 50 %-ном водном пиридине.
| Тиомочевина | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Хим. формула | CH4N2S | ||
| Физические свойства | |||
| Молярная масса | 76,12 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 182 °C | ||
| Классификация | |||
| Рег. номер CAS | 62-56-6 | ||
| PubChem | 2723790 | ||
| Рег. номер EINECS | 200-543-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | YU2800000 | ||
| ChEBI | 36946 | ||
| Номер ООН | 2811 | ||
| ChemSpider | 2005981 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Тиомочевину применяют в органическом синтезе, для получения лекарственных препаратов (напр., сульфидина).
Синтез
правитьТиомочевина может быть получена изомеризацией роданида аммония, этот синтез аналогичен классическому синтезу мочевины из цианата аммония (кислородного аналога роданида) по Вёлеру:
Вместе с тем, в отличие от мочевины, тиомочевина при нагревании находится в равновесии с роданидом аммония: равновесная смесь при температуре 140 °C содержит 28,1 % тиомочевины, при 156 °C — 26,7 %, при 180 °C — 21,8 %[1].
Подобно синтезу мочевины из аммиака и диоксида углерода, тиомочевина также может быть синтезирована при взаимодействии аммиака и сероуглерода:
Тиомочевину также получают взаимодействием H2S или сульфидов аммония либо щелочных металлов с цианамидом кальция CaCN2 в водных растворах:
Реакционная способность
правитьСтруктура молекулы тиомочевины может быть представлена мезомерными канонической тиоамидной формой и тиоимидными формами, несущими отрицательный заряд на атоме серы и положительный на атомах азота амидинового фрагмента:
В результате атом серы является сильным нуклеофильным центром и тиомочевина протонируется по атому серы с образованием солей с сильными кислотами. Атаки мягких электрофилов также направляются на атом серы: тиомочевина алкилируется алкилгалогенидами и алкилсульфатами с образованием изотиурониевых солей:
Аналогично протекает реакция тиомочевины с арилдиазониевыми солями.
S-алкилирование тиомочевины также является первой стадией её взаимодействия с эпоксидами, ведущего к образованию тииранов (эписульфидов)[2]:
Ацилирование тиомочевины галогенангидридами и ангидридами карбоновых кислот, в зависимости от условий реакции, может протекать как по сере (в мягких условиях), так и по азоту (в жестких условиях).
Альдегиды и кетоны с присоединяются к тиомочевине, образуя гидроксиалкилтиомочевины, которые при отщеплении воды превращаются в N-тиокарбамоилимины:
- H2NC(S)NH2 + R2CO H2NC(S)NHC(OH)R2
- H2NC(S)NHC(OH)R2 H2NC(S)N=CR2
Тиомочевина реагирует с бифункциональными электрофилами, образуя гетероциклические соединения. Так, например, с α-галогенкетонами тиомочевина (и её N-замещенные производные)образует 2-аминотиазолы:
при взаимодействии с 1,3-дикарбонильными соединениями - 2-меркаптопиримидины:
Применение
правитьАлкилирование тиомочевины используется алкилирование с образованием алкилтиурониевых солей и их последующим щелочным гидролизом: используется как препаративный метод синтеза алифатических тиолов[3]:
Преимуществом этого метода являются легкая очистка перекристаллизацией тиурониевых солей и достаточно высокие общие выходы тиолов.
Алкилтиурониевые соли также используются для синтеза как гуанидина аммонолизом, так и алкилгуанидинов взаимодействием с аминами в щелочной среде[4]:
- Et-S-C(NH2)2+ + R-NH2 R-NHC(=NH)NH2 + EtSH + H+ ,
синтеза алкилсульфонилхлоридов путём окисления их N-хлорсукцинимидом (NCS)[5]:
- R-S-C(NH2)2+Cl- + NCS R-SO2Cl ,
Тиомочевина широко используется в синтезе гетероциклических соединений (тиобарбитураты конденсацией с малоновыми эфирами, 2-меркаптопитимидинов при конденсации с ацеталями малонового диальдегида[6], 2-аминотиазолов конденсацией с α-галогенкетонами[7]).
Тиомочевина также используется в качестве ингибитора кислотной коррозии сталей.
Примечания
править- ↑ Тиомочевина // Большая Химическая Энциклопедия
- ↑ Zeynizadeh, Behzad; Samal Yeghaneh. Solvent-Free Conversion of Epoxides to Thiiranes by Thiourea/NH4Cl System (англ.) // Phosphorus, Sulfur, and Silicon and the Related Elements : journal. — 2008. — Vol. 183, no. 9. — P. 2280—2286. — doi:10.1080/10426500801960703.
- ↑ G. G. Urquhart et al. n-Dodecyl (lauryl) mercaptan. Org. Synth. 1941, 21, 36 Архивная копия от 20 июля 2019 на Wayback Machine DOI: 10.15227/orgsyn.021.0036
- ↑ E. Brand and F. C. Brand. Guanidoacetic acid (Glycocyamine). Org. Synth. 1942, 22, 59 Архивная копия от 20 июля 2019 на Wayback Machine DOI: 10.15227/orgsyn.022.0059
- ↑ Zhanhui Yang and Jiaxi Xu. Preparation of Alkanesulfonyl Chlorides from S-Alkyl Isothiourea Salts via N-Chlorosuccinimide Mediated Oxidative Chlorosulfonation. Org. Synth. 2014, 91, 116-124 Архивная копия от 2 июня 2018 на Wayback Machine DOI: 10.15227/orgsyn.091.0116
- ↑ Donald G. Crosby et al. 2-Mercaptopyrimidine. Org. Synth. 1963, 43, 68 Архивная копия от 2 июня 2018 на Wayback Machine DOI: 10.15227/orgsyn.043.0068
- ↑ J. R. Byers and J. B. Dickey. 2-Amino-4-methylthiazole. Org. Synth. 1939, 19, 10 Архивная копия от 2 июня 2018 на Wayback Machine DOI: 10.15227/orgsyn.019.0010
Литература
править- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.