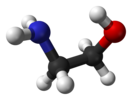
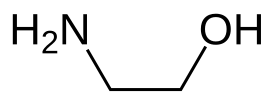
Этано̀лами́н HO-CH2CH2-NH2 (глицино́л, 2-аминоэтано́л, тривиальное название коламин) — органическое вещество класса аминоспиртов, является первичным амином и первичным спиртом. Также называется моноэтаноламином для отличия от диэтаноламина (NH(CH2CH2OH)2) и триэтаноламина (N(CH2CH2OH)3).
| Этаноламин | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Сокращения | МЭА | ||
| Традиционные названия | 2-Аминоэтан-1-ол[1], 2-амино-l-этанол, 2-аминоэтанол, моноэтаноламин, β-аминоэтанол, аминоэтиловый спирт, коламин, глицинол | ||
| Хим. формула | C2H7NO | ||
| Рац. формула | C2H7NO | ||
| Физические свойства | |||
| Молярная масса | 61,08 г/моль | ||
| Плотность | 1,012 г/см³ | ||
| Динамическая вязкость | 0,019 Па·с | ||
| Энергия ионизации | 8,96 ± 0,01 эВ[2][3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 10,3 °C | ||
| • кипения | 170 °C | ||
| • вспышки | 85 °C | ||
| • самовоспламенения | 450 °C | ||
| Пределы взрываемости | 3 ± 1 об.%[2] | ||
| Давление пара | 0,4 ± 0,1 мм рт.ст.[2] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,50 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| • в гептане | 0,41 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,4539 (20°C) | ||
| Классификация | |||
| Рег. номер CAS | 141-43-5 | ||
| PubChem | 700 | ||
| Рег. номер EINECS | 205-483-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | KJ5775000 | ||
| ChEBI | 16000 | ||
| ChemSpider | 13835336 | ||
| Безопасность | |||
| ЛД50 | 149 мг/кг | ||
| Токсичность | Класс опасности (по ГОСТ 12.1.007-76): 2-й | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические свойства
правитьВязкая маслянистая жидкость с температурой кипения 170 °C. Имеет слабый аминный запах. Смешивается с водой во всех отношениях. Хорошо растворим в этаноле, бензоле, хлороформе.
Получение
правитьВ промышленности синтез этаноламина проводится присоединением аммиака к этиленоксиду в присутствии небольшого количества воды. Процесс осуществляют в одну стадию при температуре 90—130 °С и давлении 7—10 МПа.
Наряду с моноэтаноламином при этом получаются диэтаноламин и триэтаноламин. При соотношении этиленоксид/аммиак (1:15) в продуктах реакции содержится 78,3 % моно-, 16 % ди- и 4,4 % триэтаноламинов. Этиленоксид в реакции реагирует нацело.
Соотношение этаноламинов в смеси регулируют концентрацией NH3, температурой процесса и повторным направлением в реакцию одного или двух этаноламинов.
Образующуюся смесь этаноламинов, Н2О и NH3 разделяют ректификацией, при этом аммиак в сжиженном виде повторно направляют в реактор.
В лаборатории этаноламин получают действием аммиака на этиленхлоргидрин (2-хлорэтанол):
Химические свойства
правитьЭтаноламин — слабое основание (pKa=9.50). С минеральными и сильными органическими кислотами образует соли.
При взаимодействии со сложными эфирами и карбоновыми кислотами или их ангидридами и хлорангидридами моноэтаноламин превращается в соответствующие N-(2-гидрооксиэтил)амиды кислот:
Моноэтаноламин с альдегидами (за исключением формальдегида) и кетонами даёт основания Шиффа, последние обычно находятся в равновесии с изомерными оксазолидинами:
При взаимодействии солей моноэтаноламина с KCN или NaCN и альдегидами и кетонами образуются N-(гидроксиэтил)аминонитрилы:
Моноэтаноламин при реакции с CS2 образует N-(2-гидроксиэтил)дитиокарбаминовую кислоту, которая при нагревании даёт меркаптотиазолин:
При нагревании с мочевиной образуется этиленмочевина:
С γ-бутиролактоном — N-(2-гидроксиэтил)пирролидон, который далее превращается в N-винилпирролидон:
Аммонолиз моноэтаноламина в присутствии Н2 и катализаторов гидрирования (Ni или Cu) приводит к образованию этилендиамину:
Биологическая роль
правитьЭтаноламин всегда присутствует в незначительном количестве в организме человека и животных при полноценном белковом питании. В организме он образуется при декарбоксилировании аминокислоты серина. Дальнейшие пути превращений связаны либо с синтезом одного из фосфатидов — кефалина, являющегося фосфатидилэтаноламином, либо с превращением этаноламина в холин.
Применение
правитьВодные растворы этаноламина обладают щелочной реакцией и хорошо поглощают кислые газы (диоксид углерода, диоксид серы, сероводород, а также газообразные и летучие тиолы). При нагреве раствора поглощённые газы выделяются, регенерированный раствор повторно направляют для поглощения. Благодаря обратимости растворы этаноламина широко используются в качестве абсорбента в различных процессах газоочистки (например, удаление примесей сероводорода, углекислого газа и тиолов в нефтегазовой и нефтехимической промышленности) и для разделения газов (в частности, абсорбция углекислого газа из смеси газов при производстве водорода конверсией метана).
Применяется в средствах для окраски волос в качестве заменителя раствора аммиака.
Этаноламин также является исходным веществом в промышленном синтезе таурина.
Безопасность
правитьМоноэтаноламин обладает общетоксическим действием. В соответствии с ГОСТ 12.1.005-76 моноэтаноламин отнесён к токсичным высокоопасным химическим веществам по степени воздействия на организм, 2-го класса опасности[4]. В высоких концентрациях может раздражать кожу и слизистые оболочки. Летальная доза (ЛД50 100-149 мг/кг[5] (для белых мышей, перорально).
При остром отравлении возникает раздражение слизистых оболочек, урежение дыхания, двигательное возбуждение, судороги. У белых крыс, вдыхавших воздух с концентрацией моноэтаноламина 0,2—0,4 мг/л по 5 часов ежедневно в течение 6 месяцев наблюдались изменения функционального состояния центральной нервной системы и функций печени, незначительная анемия и ретикулоцитоз, повышенный диурез и белок в моче.
Крысы, подвергавшиеся практически непрерывному отравлению в течение 30 суток при концентрации 0,164 мг/л, погибали через 14—24 суток, но выживали в тех же условиях в течение 90 дней при концентрации 0,029 мг/л. Морские свинки при непрерывном вдыхании 0,184 мг/л погибали между 10 и 28 днём. Концентрация 0,037 мг/л переносилась в течение 90 суток, а 0,12 мг/л вызывала лишь слабые признаки отравления. Собаки пережили в течение 30 дней вдыхание 0,25 мг/л и 0,015 мг/л в течение 60 дней[6].
Санитарная норма по ПДК в воздухе рабочей зоны - 1 мг/м3 (рекомендуемая)[7].
Примечания
править- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book) (англ.). — Cambridge: Royal Society of Chemistry, 2014. — P. 649, 717. — ISBN 978-0-85404-182-4. — doi:10.1039/9781849733069-FP001.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0256.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ ГОСТ 12.1.005-76 Система стандартов безопасности труда (ССБТ). Общие санитарно-гигиенические требования к воздуху рабочей зоны
- ↑ ГОСТ 12.1.007-76 Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности
- ↑ Вредные вещества в промышленности : Справочник для химиков, инженеров и врачей : в 3 т. / Под общ. ред. засл. деят. науки проф. Н. В. Лазарева и д-ра мед. наук Э. Н. Левиной. — 7-е изд., перераб. и доп. — Л. : Химия, 1976. — Т. 2. — С. 243. — ББК 124.432я221.
- ↑ ГОСТ 12.1.005-88. Система стандартов безопасности труда (ССБТ). Общие санитарно-гигиенические требования к воздуху рабочей зоны (с Изменением N 1)
Литература
править- Кремлёв А. М., Менделеев Д. И. Этаноламин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Якушкин M. И. Этаноламины // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ТУ 2423-159-00203335-2004 : Моноэтаноламин. Технические условия : [арх. 10 июля 2018]. — Казаньоргсинтез, 2005.