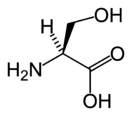
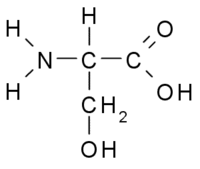
Сери́н (англ. Serine; α-амино-β-оксипропионовая кислота; 2-амино-3-гидроксипропановая кислота) — гидроксиаминокислота, существует в виде двух оптических изомеров — L и D. Из-за наличия гидроксильной группы относится к полярным незаряженным аминокислотам[1].
| Серин | |||
|---|---|---|---|
  | |||
| Общие | |||
| Систематическое наименование |
2-амино-3- гидроксипропановая кислота |
||
| Сокращения |
Сер, Ser, S UCU,UCC,UCA,UCG;AGU,AGC |
||
| Хим. формула | HO2C-CH(NH2)CH2OH | ||
| Рац. формула | C3H7NO3 | ||
| Физические свойства | |||
| Молярная масса | 105,09 г/моль | ||
| Плотность | 1,537 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 228 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты |
2,13 9,05 |
||
| Изоэлектрическая точка | 5,86 | ||
| Классификация | |||
| Рег. номер CAS | [56-45-1] | ||
| PubChem | 5951 и 6857581 | ||
| Рег. номер EINECS | 200-274-3 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 17115 и 33384 | ||
| ChemSpider | 5736 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
L- серин участвует в построении почти всех природных белков. Впервые серин был выделен из шёлка, в белках которого он обнаружен в наибольших количествах. Серин относится к группе заменимых аминокислот, в организме человека он может синтезироваться из промежуточного продукта гликолиза — 3-фосфоглицерата.
Транспорт серина через плазмалемму осуществляется при помощи трёх различных систем:
- Система А (преимущественно для аланина) — натрий-зависимый транспортер для небольших нейтральных аминокислот. Она обнаружена во многих клетках человеческого тела и включает транспортёры SNAT1, SNAT2 и SNAT4. Процесс рекрутирования из везикул (которые находятся под плазмалеммой) на поверхность клетки очень чувствителен к уровню гормонов и аминокислот. Эта система играет роль в поглощении аминокислот тканями после приёма пищи и в потреблении аминокислот печенью, которые используются для глюконеогенеза при голодании.
- Система ASC (преимущественно для аланина, серина и цистеина) - натрий-зависимый транспортер, включающий транспортёры ASCT1 и ASCT2. Предполагается, что ASCT1 является основным транспортёром серина в головном мозге, где он играет ключевую роль в транспортировке этой аминокислоты из астроцитов и захвате его нейронами. Мутации в ASCT1 вызывают умственную отсталость, прогрессирующую микроцефалию, спастичность и истончение мозолистого тела.
- Система asc — гетеродимерный натрий-независимый аминокислотный обменник. Включает транспортёр Asc-1, который представлен в головном мозге и имеет высокое сродство как к L- , так и к и D-серину[2].
Серин участвует в образовании активных центров ряда ферментов (эстераз, пептидгидролаз), обеспечивая их функцию. Протеолитические ферменты, активные центры которых содержат серин, играющий важную роль при выполнении каталитической функции, относят к отдельному классу сериновых пептидаз.
Действие некоторых фосфорорганических соединений основано на необратимом присоединении молекулы яда к OH- группам остатков серина, приводящему к полному ингибированию каталитической активности ферментов. Токсический эффект прежде всего связан с ингибированием ацетилхолинэстеразы.
Фосфорилирование остатков серина в составе белков имеет важное значение в механизмах межклеточной передачи сигналов.
Кроме того, серин участвует в биосинтезе ряда других аминокислот: глицина, цистеина, метионина, триптофана.
Глицин образуется из серина при действии серин-оксиметилтрансферазы в присутствии тетрагидрофолиевой кислоты. Кроме того, серин является исходным продуктом синтеза пуриновых и пиримидиновых оснований, сфинголипидов, этаноламина, и других важных продуктов обмена веществ.
В процессе распада в организме серин подвергается прямому или непрямому дезаминированию с образованием пировиноградной кислоты, которая в дальнейшем включается в цикл Кребса.
D-серин образуется из L-серина при помощи фермента серин-рацемазы и является эндогенным лигандом глицинового сайта NMDA-рецептора. Деградация D-серина происходит под воздействием оксидазы D-аминокислот.
Примечания
править- ↑ Д. Нельсон, М. Кокс. Основы биохимии Ленинджера в трех томах. Том 1 / пер. с англ. канд. хим. наук Т. П. Мосоловой, канд. хим. наук Е. М. Молочкиной, канд. биол. наук В. В. Белова; под ред. академика РАН А. А. Богданова и член-корр. РАН С. Н. Кочеткова. — М.: Лаборатория знаний, 2019. — С. 120. — 694 с. — ISBN 978-5-00101-014-2.
- ↑ Holecek, Milan. Serine Metabolism in Health and Disease and as a Conditionally Essential Amino Acid (англ.) // Nutrients : журнал. — 2022. — 9 May (vol. 14, no. 9). — P. 4-5.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |