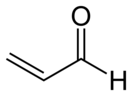
Акролеи́н (лат. acris — острый, едкий + oleum — масло) (пропеналь) — H2C=CH-CHO, альдегид акриловой кислоты, простейший ненасыщенный альдегид.
| Акролеин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Проп-2-ен-1-аль | ||
| Традиционные названия | Акролеин, пропеналь, акрилальдегид | ||
| Хим. формула | C3H4O | ||
| Физические свойства | |||
| Молярная масса | 56,0633 ± 0,003 г/моль | ||
| Плотность | 0,843 г/см³ | ||
| Энергия ионизации | 974,7911 кДж/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −87 °C | ||
| • кипения | 52,7 °C | ||
| • вспышки | -26 °C | ||
| • самовоспламенения | 234 °C | ||
| Пределы взрываемости | 2,8–31 % % | ||
| Критическая точка | 232,85 °С | ||
| Давление пара | 29 кПа (20 °С) | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 209 г/100 мл | ||
| Структура | |||
| Дипольный момент |
2,552 ± 0,003 (цис-положение), 3,117 ± 0,004 (транс-положение) |
||
| Классификация | |||
| Рег. номер CAS | 107-02-8 | ||
| PubChem | 7847 | ||
| Рег. номер EINECS | 203-453-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | AS1050000 | ||
| ChEBI | 15368 | ||
| Номер ООН | 1092 | ||
| ChemSpider | 7559 | ||
| Безопасность | |||
| Предельная концентрация | 0,03 мг/м3 | ||
| ЛД50 |
46 мг/кг (белые крысы, перорально); 7 мг/кг (кролики, перорально); 28 мг/кг (мыши, перорально) |
||
| Токсичность | высокотоксичен, особенно опасны его пары, сильный ирритант, лакриматор | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При обычных условиях легколетучая жидкость с резким запахом, пары вызывают слезоточение, сильный лакриматор.
Реакционная способность
правитьАкролеин как непредельный альдегид, проявляет реакционную способность, свойственную как олефинам, так и альдегидам. Так, акролеин образует ацетали.
Альдегидная группа легко, даже при стоянии на воздухе окисляется до карбоксильной:
и восстанавливается до гидроксильной:
- .
Карбонильная группа акролеина находится в сопряжении с двойной связью, что обуславливает его высокую реакционную способность по отношению к нуклеофилам, при этом присоединение идёт по β-атому углерода:
- ,
- .
Присоединение азотистой кислоты ( ) к акролеину используется как препаративный метод синтеза 3-нитропропаналя[1].
Галогены присоединяются к акролеину по двойной связи с образованием дигалогенпроизводного, которое далее отщепляет галогеноводород с образованием α-галогенакролеина:
- ;
- .
Благодаря наличию электроноакцепторной альдегидной группы, сопряжённой с двойной связью, акролеин является диенофилом и реагирует с диенами с образованием продуктов циклоприсоединения (реакция Дильса-Альдера):
Синтез
правитьВ лаборатории акролеин получается дегидратацией глицерина в присутствии гидросульфата калия[2]:
В промышленности акролеин получают каталитическим окислением пропилена над оксидными висмут-молибденовыми катализаторами или оксидом меди. Ранее в промышленности был распространён процесс парофазной кротоновой конденсации ацетальдегида с формальдегидом (устаревший метод):
Токсичность, особенности обращения
правитьВследствие своей чрезвычайно высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые оболочки глаз и дыхательных путей соединением, сильный лакриматор. Максимально разовая предельно-допустимая концентрация в воздухе 0,03 мг/м³. Среднесуточная предельно-допустимая концентрация в воздухе 0,01 мг/м³ (Список ПДК ГН 2.1.6 1338-03). Вызывает мутагенез у микроорганизмов и дрожжей, проявляет мутагенные свойства на культуры клеток млекопитающих[3].
Класс опасности — 2 (вещества высокоопасные) согласно ГОСТ 12.1.007-76.
Акролеин является одним из продуктов термического разложения глицерина и жиров-триглицеридов, чем объясняются раздражающие слизистые оболочки свойства дыма горелого жира.
Аспекты охраны труда
правитьПДК в воздухе рабочей зоны[4] 0,2 мг/м3. По данным[5] люди могут не почувствовать запах при опасной концентрации. Порог восприятия запаха может быть 0,8 мг/м3[6] и свыше 4,1 мг/м3[7]. Для защиты от акролеина следует использовать эффективные средства коллективной защиты.
Применение
правитьПрименяют для синтеза акрилонитрила, глицерина, пиридина, β-пиколина, аминокислот (метионина), этилвиниловых эфиров, глутарового альдегида, полиакролеина. Также используется в производстве лекарственных препаратов.
Во время Первой мировой войны использовался в качестве химического оружия.
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Примечания
править- ↑ "3-NITROPROPANAL, 3-NITROPROPANOL, AND 3-NITROPROPANAL DIMETHYL ACETAL". Organic Syntheses. 77: 236. 2000. doi:10.15227/orgsyn.077.0236. eISSN 2333-3553. ISSN 0078-6209. Архивировано 14 апреля 2021. Дата обращения: 23 сентября 2020.
- ↑ "ACROLEIN". Organic Syntheses. 6: 1. 1926. doi:10.15227/orgsyn.006.0001. eISSN 2333-3553. ISSN 0078-6209. Архивировано 21 сентября 2020. Дата обращения: 23 сентября 2020.
- ↑ Acrolein MSDS. Дата обращения: 26 марта 2012. Архивировано из оригинала 14 февраля 2012 года.
- ↑ (Роспотребнадзор). № 1797. Проп-2-ен-1-аль (акрилальдегид; акролеин) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А. Ю. Поповой. — Москва, 2018. — С. 123. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ МКХБ Международная организация труда. МКХБ № 0090. Акролеин. Пропеналь. www.ilo.org/dyn/icsc/ (2018). Дата обращения: 12 ноября 2019. Архивировано 12 апреля 2021 года.
- ↑ Плотникова М. М. Материалы к гигиенической оценке акролеина как атмосферного загрязнения // Министерство здравоохранения СССР Гигиена и санитария. — Москва: Медицина, 1957. — Июнь (№ 6). — С. 10—15. — ISSN 0016-9900.
- ↑ Katz S. H. and E. J. Talbert. Table 3. Intensities of odors versus concentrations in parts per million // Intensities of Odors and Irritating Effects of Warning Agents for Inflammable and Poisonous Gases (англ.). — Washington, D.C.: U.S. Bureau of Mines, U.S. Dept. of Commerce, 1930. — P. 14. — 40 p. — (Technical Report no. 480).