Гидросульфа́т ка́лия — кислая соль щелочного металла калия и серной кислоты с химической формулой KHSO4. Белый порошок.
| Гидросульфат калия | |
|---|---|
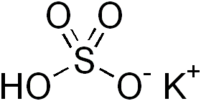 | |
 | |
| Общие | |
| Систематическое наименование |
Гидросульфат калия |
| Традиционные названия | Сернокислый калий, кислый; бисульфат калия |
| Хим. формула | KHSO4 |
| Физические свойства | |
| Состояние | белый порошок |
| Молярная масса | 136,17 г/моль |
| Плотность | 2,24-2,61; 2,322 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 210; 218,6; 222 °C |
| Энтальпия | |
| • образования | -1163,3 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 36,30; 121,6100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7646-93-7 |
| PubChem | 516920 и 18674734 |
| Рег. номер EINECS | 231-594-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E515(ii) |
| RTECS | TS7200000 |
| Номер ООН | 2509 |
| ChemSpider | 56396 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
править- Действием серной кислоты на гидроксид калия:
- или закисление сульфата калия:
- Кипячение с концентрированной серной кислотой безводного хлорида калия:
Физические свойства
правитьГидросульфат калия — бесцветные кристаллы ромбической сингонии, пространственная группа P bca, параметры ячейки a = 0,840 нм, b = 0,979 нм, c = 1,893 нм, Z = 16.
Хорошо растворяется в воде, не растворяется в ацетоне и этаноле. Кристаллогидратов не образует.
Химические свойства
править- Водные растворы гидросульфата калия имеют кислую реакцию из-за диссоциации аниона:
- При нагревании гидросульфат калия разлагается:
- Реакция с щелочами приводит к образованию средней соли:
- Взаимодействует с некоторыми солями при сплавлении:
- Реакцией с гидроксидом циркония и получают сульфат циркония(IV)-тетракалия:
- Образует пероксидное соединение с концентрированным раствором пероксида водорода:
- При сплавлении переводит многие соединения в растворимую форму, например:
Применение
править- Как компонент флюса в металлургии.
- Сульфирующий агент в производстве красителей.
- В аналитической химии для перевода некоторых соединений в легкорастворимые формы.
Литература
править- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |