Пируватдегидрогеназный комплекс
Пируватдегидрогена́зный ко́мплекс, ПДК (англ. Pyruvate dehydrogenase complex, PDH, PDC) — белковый комплекс, осуществляющий окислительное декарбоксилирование пирувата. Он включает в себя три фермента и два вспомогательных белка, а для его функционирования необходимы пять кофакторов (СоА, NAD+, тиаминпирофосфат (ТРР), FAD и липоевая кислота (липоат)). PDH локализован у бактерий в цитозоле, а у эукариот — в митохондриальном матриксе. Суммарное уравнение катализируемой реакции таково[1]:
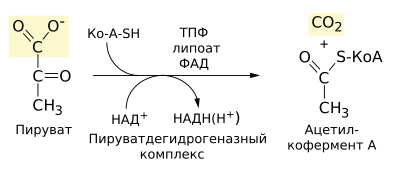
Детально механизм этого процесса, а также его регуляция обсуждаются в статье Окислительное декарбоксилирование пирувата. Ниже рассмотрены особенности собственно ферментного комплекса.
Коферменты
правитьКомбинированное дегидрирование и декарбоксилирование пирувата до ацильной группы[англ.], которая в дальнейшем войдёт в ацетил-СоА, осуществляется тремя различными ферментами, для функционирования которых необходимы пять различных коферментов или простетических групп: тиаминпирофосфат (ТРР), FAD, кофермент А (СоА), NAD и липоат. Четыре из них являются производными витаминов: тиамина, или витамина В1 (ТРР), рибофлавина, или витамина В2 (FAD), ниацина, или витамина РР (NAD), и пантотеновой кислоты, или витамин В5 (СоА)[2].
FAD и NAD являются переносчиками электронов, а ТРР известен также как кофермент пируватдекарбоксилазы[англ.], участвующей в брожении[2].
Кофермент А имеет активную тиольную группу (—SH), которая имеет критическое значение для функционирования СоА в качестве переносчика ацильной группы в ряде метаболических реакций. Ацильные группы при этом ковалентно связываются с тиольной группой, образуя тиоэфиры. Из-за их относительно высокой стандартной свободной энергии гидролиза тиоэфиры обладают высоким потенциалом для переноса ацильных групп к различным молекулам-акцепторам. Поэтому ацетил-СоА иногда также называют «активированной уксусной кислотой»[2][3].
Пятый кофактор пируватдегидрогеназного комплекса, липоат, имеет две тиольные группы, которые могут подвергаться обратимому окислению с образованием дисульфидной связи (—S—S—), подобно тому, как это происходит между двумя остатками аминокислоты цистеина в белке. Из-за своей способности подвергаться окислению и восстановлению липоат может служить как в качестве переносчика электронов (или H+), так и ацильных групп[2].
Ферменты
править| Фермент | Сокращение | кофактор | # прокариоты | # эукариоты |
|---|---|---|---|---|
| пируватдегидрогеназа шифр КФ 1.2.4.1 |
E1 | Тиаминпирофосфат | 24 | 30 |
| дигидролипоилтрансацетилаза шифр КФ 2.3.1.12 |
E2 | липоевая кислота коэнзим А |
24 | 60 |
| дигидролипоилдегидрогеназа шифр КФ 1.8.1.4 |
E3 | ФАД НАД+ |
12 | 12 |
Пируватдегидрогеназный комплекс (PDH)
Пируватдегидрогеназный комплекс (PDH) включает 3 фермента: пируватдегидрогеназу[англ.] (Е1), дигидролипоилтрансацетилазу (Е2) и дигидролипоилдегидрогеназу[англ.] (Е3). Каждый из этих ферментов присутствует в комплексе во множестве копий. Количество копий каждого фермента, а следовательно, и размер комплекса варьирует среди различных видов. Комплекс PDH млекопитающих достигает около 50 нм в диаметре, что более чем в 5 раз превышает диаметр целой рибосомы; эти комплексы достаточно велики, чтобы быть различимыми в электронный микроскоп. В PDH коровы и грамположительной бактерии Bacillus stearothermophilus[англ.][4] входят 60 идентичных копий Е2, которые формируют пентагональный додекаэдр (коровая часть[англ.] комплекса) диаметром около 25 нм. В кубический[5] кор PDH у грамотрицательной бактерии Escherichia coli входит 24 копии Е2. К Е2 присоединяется простетическая группа липоат, которая связывается амидной связью к ε-аминогруппе остатка лизина, входящего в состав Е2. Е2 состоит из трёх функционально различных доменов: аминотерминального липоильного домена, содержащего остаток лизина, связывающийся с липоатом; центрального Е1- и Е3-связывающего домена; внутреннего корового ацилтрансферазного домена, содержащего активные центры ацилтрансферазы. У дрожжей в PDH имеется единственный липоильный домен, у млекопитающих — два, а у E. coli — три. Домены Е2 разделяются линкерными последовательностями аминокислот, состоящими из 20—30 аминокислотных остатков, причём в них остатки аланина и пролина перемежаются с заряженными аминокислотыми остатками. Такие линкеры обычно принимают протяжённую форму, тем самым отделяя друг от друга три домена[6].
С активным центром Е1 связывается ТРР, а с активным центром Е3 — FAD. У человека фермент Е1 представляет собой тетрамер, состоящий из 4 субъединиц: двух Е1α и двух Е1β[7]. Также в состав комплекса PDH входят два регуляторных белка — протеинкиназа и фосфопротеинфосфатаза. Такая основная структура из Е1–Е2–Е3 оставалась консервативной в ходе эволюции. Комплексы такого устройства принимают участие и в других реакциях, например, окислении α-кетоглутарата в ходе цикла Кребса и окислении α-кетокислот, образующихся при катаболической утилизации разветвлённых аминокислот: валина, изолейцина, лейцина. У изученных видов Е3 PDH идентичен Е3 двух вышеупомянутых комплексов. Примечательное сходство структур белков, кофакторов и механизмов реакций, осуществляемых этими комплексами, свидетельствует об общности их происхождения[1]. При прикреплении липоата к лизину Е2 образуется длинная гибкая «рука», которая может перемещаться с активного центра Е1 в активные центры Е2 и Е3, то есть на расстояния предположительно 5 нм и более[8].
Установлено, что у эукариот в состав пируватдегидрогеназного комплекса также входит 12 субъединиц некаталитического E3-связывающего белка[англ.] (E3BP). Точное его расположение неизвестно, однако криоэлектронная микроскопия показала, что он связывается с каждой из граней кора PDH дрожжей. Было высказано предположение, что этот белок заменил собой несколько субъединиц E2 в PDH коровы[9].
Пируватдегидрогеназный комплекс имеется и у некоторых анаэробных бактерий, например, Zymonomonas mobilis. У этой бактерии до 98 % пирувата участвует в спиртовом брожении, и лишь малая его часть окисляется до ацетил-СоА, СО2 и NADH. PDH Z. mobilis состоит из 4 ферментов: E1α массой 38,6 кДа, Е1β массой 49,8 кДа, Е2 массой 48 кДа и Е3 массой 50 кДа. Уникальной особенностью PDH этой бактерии является наличие в субъединице Е1β липоильного домена. Так же, как и у коровы, кор комплекса представлен субъединицей Е2, а сам комплекс организован в виде пентагонального додекаэдра. Гены, кодирующие субъединицы PDH этой бактерии, собраны в два различных кластера. Поскольку у Z. mobilis отсутствует ряд ферментов цикла трикарбоновых кислот, то PDH у этой бактерии выполняет исключительно анаболические функции[10].
Гены
правитьУ человека гены, кодирующие ферменты PDH, расположены следующим образом. Ген E1α — PDHA1 — локализован на X-хромосоме. Известно более 30 мутантных аллелей этого гена, приводящих к развитию пируватдегидрогеназной недостаточности[англ.] — заболеванию, симптомы которого могут варьировать от слабовыраженного лактатацидоза до серьёзных пороков развития[11]. Накопление лактата в этом случае происходит из-за того, что PDH не может превращать пируват в ацетил-СоА, и из-за накопления пирувата лактат не может в него превращаться. Мужчины, чья Х-хромосома несёт мутантную аллель, обычно погибают в раннем возрасте, однако женщины тоже в некоторой степени подвержены этому заболеванию из-за инактивации одной из Х-хромосом. В клетках семенников имеется особая копия E1α — PDHA2, этот ген локализован на хромосоме 4[12].
Ген E1β — PDHB — расположен на хромосоме 3. Известно только 2 мутантные аллели этого гена, в гомозиготном состоянии приводящие к смерти в течение первого года жизни из-за пороков развития. Возможно, существуют и другие мутантные аллели, приводящие к смерти ещё до рождения. Ген E2 — DLAT (от англ. dihydrolipoamide s-acetyltransferase) — локализован на 11-й хромосоме. Известны две аллели этого гена, в гомозиготе приводящие к проблемам, компенсируемым правильной диетой; вполне вероятно, что другие мутантные аллели приводят к смерти на внутриутробном этапе. Ген E3 — DLD — расположен на хромосоме 7. Этот ген имеет множество аллелей, многие из которых приводят к появлению генетических болезней, однако, связанных не с PDH, а с α-кетоглутаратдегидрогеназным комплексом[англ.] и проявляющихся в нарушении обмена аминокислот[7][12].
Примечания
править- ↑ 1 2 Nelson, Cox, 2008, p. 616.
- ↑ 1 2 3 4 Nelson, Cox, 2008, p. 617.
- ↑ Нетрусов, Котова, 2012, с. 123.
- ↑ Henderson C. E., Perham R. N. Purificaton of the pyruvate dehydrogenase multienzyme complex of Bacillus stearothermophilus and resolution of its four component polypeptides. (англ.) // The Biochemical journal. — 1980. — Vol. 189, no. 1. — P. 161—172. — PMID 7458900.
- ↑ Izard T., Aevarsson A., Allen M. D., Westphal A. H., Perham R. N., de Kok A., Hol W. G. Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1999. — Vol. 96, no. 4. — P. 1240—1245. — PMID 9990008.
- ↑ Nelson, Cox, 2008, p. 618.
- ↑ 1 2 Olson S., Song B. J., Huh T. L., Chi Y. T., Veech R. L., McBride O. W. Three genes for enzymes of the pyruvate dehydrogenase complex map to human chromosomes 3, 7, and X. (англ.) // American journal of human genetics. — 1990. — Vol. 46, no. 2. — P. 340—349. — PMID 1967901.
- ↑ Nelson, Cox, 2008, p. 618—619.
- ↑ Stoops J. K., Cheng R. H., Yazdi M. A., Maeng C. Y., Schroeter J. P., Klueppelberg U., Kolodziej S. J., Baker T. S., Reed L. J. On the unique structural organization of the Saccharomyces cerevisiae pyruvate dehydrogenase complex. (англ.) // The Journal of biological chemistry. — 1997. — Vol. 272, no. 9. — P. 5757—5764. — PMID 9038189.
- ↑ Martin Dworkin, Stanley Falkow et al. The Prokaryotes: A Handbook on the Biology of Bacteria.. — Third edition. — Springer Science & Business Media, 2006. — Vol. 5. — P. 211—212. — 919 p. — ISBN 978-0387-25495-1.
- ↑ Zhilwan Rahim. Pyruvate Dehydrogenase Complex Deficiency (PDCD). // Undergraduate Research Journal for the Human Sciences. — 2011. — Vol. 10. Архивировано 12 августа 2014 года.
- ↑ 1 2 Laurence A. Moran. Human Genes for the Pyruvate Dehydrogenase Complex (2007). Дата обращения: 10 августа 2014. Архивировано 12 августа 2014 года.
Литература
править- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |