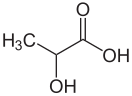
Моло́чная кислота́ (химическая формула — C3H6O3) — cлабая химическая органическая кислота, относящаяся к классу предельных карбоновых кислот.
| Молочная кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-гидроксипропановая кислота | ||
| Традиционные названия | Молочная кислота | ||
| Хим. формула | CH3CH(OH)COOH | ||
| Рац. формула | C3H6O3 | ||
| Физические свойства | |||
| Молярная масса | 90,08 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • кипения | 122 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 3,86 (при 25 °C) | ||
| Классификация | |||
| Рег. номер CAS |
50-21-5; (S)-Молочная кислота 79-33-4; (R)-Молочная кислота 103226-41-7. |
||
| PubChem | 612 и 19789253 | ||
| Рег. номер EINECS | 200-018-0 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E270 | ||
| ChEBI | 78320 | ||
| ChemSpider | 592 | ||
| Безопасность | |||
| Краткие характер. опасности (H) |
H315, H318 |
||
| Меры предостор. (P) |
P280, P305+P351+P338 |
||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При стандартных условиях молочная кислота — это одноосновная карбоновая оксикислота белого цвета с характерным запахом. Соли и эфиры молочной кислоты называются лактатами.
Малотоннажная химия производит молочную кислоту 4 сортов: химически чистую, «фармакопейную», «техническую» и «пищевую».
История
правитьМолочную кислоту открыл шведский химик Карл Шееле. В 1780 году он выделил её из прокисшего молока в виде коричневого сиропа. Французский химик Анри Браконно обнаружил, что она образуется при молочнокислом брожении[1].
В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты.
Производство молочной кислоты в Советском Союзе было организовано в 1930 году на основе работ Сергея Павловича Костычева и Владимира Степановича Буткевича[2].
Физические свойства
правитьМолочная кислота является простейшей хиральной карбоновой кислотой и может существовать в виде двух энантиомеров: L-(+)-молочной кислоты, D-(–)-молочной кислоты или их рацемической смеси — DL-молочной кислоты. Если в смеси энантиомеров один находится в избытке, его можно выделить дробными перекристаллизациями из смеси диэтилового эфира и диизопропилового эфира[1]. Чистые энантиомеры имеют температуру плавления 52,7—52,8 °С[1].
Молочная кислота очень гигроскопична и обычно существует в виде водного раствора с концентрацией до 90 мас. %. В связи с этим очень сложно установить её температуру плавления; литература приводит значения от 18 до 33 °С. Кроме того, в таких растворах присутствует значительное количество лактоилмолочной кислоты и других олигомеров молочной кислоты[1].
Молочная кислота растворима в воде, этаноле и других органических растворителях, смешивающихся с водой, а также в диэтиловом эфире. Она практически нерастворима в бензоле и хлороформе[3].
Химические свойства
правитьПри взаимодействии с окислителями молочная кислота разлагается. При окислении кислородом воздуха или азотной кислотой в присутствии железа или меди она превращается в муравьиную кислоту, уксусную кислоту, щавелевую кислоту, уксусный альдегид, углекислый газ и пировиноградную кислоту. Молочную кислоту можно восстановить до пропионовой кислоты действием иодоводорода[4]
Промышленный интерес представляет дегидратация молочной кислоты до акриловой кислоты и её восстановление до пропиленгликоля[5].
Поскольку молочная кислота является одновременно карбоновой кислотой и спиртом, она вступает в межмолекулярную этерификацию, давая лактоилмолочную кислоту. При дальнейшей конденсации образуется лактид — циклический сложный эфир. Также при конденсации могут образовываться линейные полилактиды. Эти соединения являются примесями в молочной кислоте. Так, в 6,5%-й молочной кислоте содержится около 0,2 % лактоилмолочной кислоты, 88%-я молочная кислота содержит меньше 60 % свободной молочной кислоты, а 100%-я — только 32 %[3].
Получение
правитьФерментативное получение
правитьВ промышленности молочную кислоту получают либо ферментативным способом, либо синтетическим. Первый из них имеет преимущество, поскольку приводит к молочной кислоте с более высокой стереохимической чистотой, поэтому новые производства, открывавшиеся с 1995 года, пользуются этим способом[5].
Для ферментативного производства молочной кислоты необходимо иметь углеводное сырьё, питательные вещества и соответствующие микроорганизмы. В качестве сырья используют глюкозу, кукурузные сиропы, мелассу, сок сахарной свёклы, сыворотку и крахмал. Питательными веществами являются пептиды и аминокислоты, фосфаты, соли аммония и витамины. Здесь находят применение дрожжевой экстракт, кукурузный ликёр[англ.], кукурузная глютеновая мука[англ.], солодовые ростки, соевый или мясной пептон. Молочную кислоту из углеводов вырабатывают культуры Lactobacillus, Bacillus и Rhizopus. Последняя из них является грибной и не требует сложных источников азота, хотя и даёт более низкий выход, чем бактериальные культуры[5].
Во время процесса вырабатывается кислота, поэтому необходимо поддерживать pH в области 5,0—6,5: для этого используют гидроксид кальция, карбонат кальция, аммиак и гидроксид натрия. Из-за этого в процессе ферментации образуются соответствующие соли молочной кислоты. Разработка новых подходов к ферментации связана с выведением бактерий, способных работать в области низких pH: это позволило бы получать саму молочную кислоту, а не её соли, снизило бы затраты на подщелачивающие реагенты и на серную кислоту, используемую для выделения молочной кислоты из солей[5].
После ферментации молочную кислоту подвергают очистке. Микроорганизмы отделяют флокуляцией в щелочной среде либо ультрафильтрацией. Образовавшиеся соли молочной кислоты переводят в саму кислоту под действием серной кислоты. При этом образуется также малополезный сульфат кальция. Ведётся поиск других методов очистки, при которых образование этой побочной соли не происходило бы. Для некоторых пищевых целей смесь пропускают через активированный уголь и ионообменную колонну[6].
Для фармацевтической промышленности и получения полимеров необходима более глубокая очистка. Интерес представляет экстракция молочной кислоты в органическую фазу длинноцепными третичными аминами, а затем обратная экстракция в воду. Этот метод позволяет эффективно очистить продукт от остаточных углеводов и белков. Также возможна перегонка молочной кислоты, если предпринимаются меры против её олигомеризации[6].
Выход молочной кислоты в процессе ферментации составляет 85—95 %. Побочными продуктами являются муравьиная и уксусная кислота.[5].
Синтетическое получение
правитьС 1960-х гг. рацемическую молочную кислоту производят в промышленности также синтетически. Подход основан на реакции ацетальдегида с циановодородом и последующем гидролизе образовавшегося лактонитрила. Недостатком синтетического подхода является то, что получаемая молочная кислота является рацемической, а подходящий и дешёвый хиральный катализатор пока не найден. Важнейшим крупным производителем синтетической молочной кислоты является фирма «Musashino»[6].
Экономические аспекты
правитьГодовая потребность в молочной кислоте составляет примерно 450 тыс. тонн. Крупнейшим производителем молочной кислоты является компания NatureWorks LLC: её завод, размещённый в штате Небраска (США), имеет приблизительную мощность 180 тыс. тонн в год. Это в 3—4 раза больше, чем у следующего завода по порядку. Рынок молочной кислоты очень чувствителен к потребности в полилактиде, поскольку его производство является либо вскоре станет крупнейшим направлением использования молочной кислоты[7].
Молочная кислота в организме человека и животных
правитьМолочная кислота формируется при анаэробном распаде глюкозы. Иногда называемая «кровяным сахаром» глюкоза является главным углеводом в нашем организме. Глюкоза — это основной источник энергии для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго мышцы смогут сокращаться при физической нагрузке.
Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс её синтеза часто называют «анаэробным метаболизмом» (см. Аэробная тренировка). Ранее считалось, что мышцы производят молочную кислоту при нехватке кислорода в крови. Однако современные исследования показывают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления[8][9]. Резкое увеличение (в 2—3 раза) уровня лактата в сыворотке крови наблюдается при тяжёлых расстройствах кровообращения, таких как геморрагический шок, острая левожелудочковая недостаточность и др., когда одновременно страдает и поступление кислорода в ткани, и печёночный кровоток.
Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве источника энергии, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов человек использует в качестве топлива, тем больше производство молочной кислоты.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) повышено[10].
Регулятор обмена
правитьЧтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна — она с лёгкостью сама проходит через клеточные мембраны.
Анализ
правитьКоличественный анализ молочной кислоты обычно проводят титрованием гидроксидом натрия в присутствии фенолфталеина. Этот способ не подходит для концентрированных растворов, потому что в них молочная кислота частично находится в виде лактоилмолочной кислоты. Если такой раствор нужно оттитровать, используют приём обратного титрования: молочную кислоту обрабатывают избытком щёлочи (лактоилмолочная кислота при этом гидролизуется), а затем остаток щёлочи оттитровывают соляной кислотой[7].
В промышленности и исследовательских лабораториях молочную кислоту анализируют методом ВЭЖХ. Содержание энантиомерных форм в молочной кислоте можно определить ферментативным методом либо ВЭЖХ на хиральной колонке. Такие колонки, как и образцы высокочистых энантиомеров молочной кислоты коммерчески доступны[7].
Молочную кислоту можно обнаружить по следующим качественным реакциям:
- Взаимодействие с n-оксидифенилом и серной кислотой:
При осторожном нагревании молочной кислоты с концентрированной серной кислотой она вначале образует уксусный альдегид и муравьиную кислоту; последняя немедленно разлагается:
CH3CH(OH)COOH → CH3CHO + HCOOH (→ H2O + CO)
Уксусный альдегид взаимодействует с n-оксидифенилом, причём, по-видимому, происходит конденсация в o-положении к OH-группе с образованием 1,1-ди(оксидифенил)этана:
В растворе серной кислоты медленно окисляется в фиолетовый продукт неизвестного состава. Поэтому, как и при обнаружении гликолевой кислоты с помощью 2,7-диоксинафталина, в данном случае происходит взаимодействие альдегида с фенолом, при котором концентрированная серная кислота действует как конденсирующий агент и окислитель. Такую же цветную реакцию дают α-оксимасляная и пировиноградная кислоты.
Выполнение реакции:
В сухой пробирке нагревают в течение 2 минут на водяной бане при 85 °C каплю исследуемого раствора с 1 мл концентрированной серной кислоты. После этого охлаждают под краном до 28 °C, добавляют небольшое количество твёрдого n-оксидифенила и, перемешав несколько раз, дают постоять 10-30 минут. Фиолетовое окрашивание появляется постепенно и через некоторое время становится более глубоким. Открываемый минимум: 1,5⋅10−6 г молочной кислоты.
- Взаимодействие с подкисленным серной кислотой раствором перманганата калия
Выполнение реакции: В пробирку прилить 1 мл молочной кислоты, а затем немного подкисленного серной кислотой раствора перманганата калия. Нагревать в течение 2 минут на слабом огне. Ощущается запах уксусной кислоты.
С3Н6О3 + [O] = C3Н4O3 + H2O↑
Продуктом данной реакции может быть пировиноградная кислота С3Н4О3, которая тоже имеет запах уксусной кислоты. Однако пировиноградная кислота при обычных условиях неустойчива и быстро окисляется до уксусной кислоты, поэтому реакция протекает согласно суммарному уравнению:
С3Н6О3 + 2[O] = CH3COOH + CO2↑ + H2O
- Взаимодействие с фенолятом железа
Описание реакции: Эта реакция называется реакцией Уффельмана и используется, например, в клинической медицине для определения присутствия молочной кислоты в желудочном соке, открыта Юлиусом Уффельманом[нем.] в 1880-х гг. Для проведения реакции нужно растворить одну каплю хлорида железа и 0,4 грамма фенола в 50 см3 воды. Затем добавить тестируемую жидкость, если в ней есть молочная кислота, то синий цвет раствора сменится жёлтым[11][12], поскольку образуется лактат железа.
Применение
правитьМолочная кислота используется преимущественно в двух сферах: пищевой промышленности и производстве полимеров, а также в других промышленных целях[13].
В пищевой промышленности молочная кислота используется как консервант и подкислитель. Благодаря тому, что её соли хорошо растворимы в воде, их также можно использовать в тех продуктах, где важно значение pH. Молочная кислота и её соли используются в напитках, конфетах, мясных изделиях и соусах. Лактат кальция добавляется в продукты как источник кальция.[13]
В полимерной промышленности из молочной кислоты получают полилактид. Производится он из лактида полимеризацией с раскрытием цикла. Сам же лактид получают конденсацией молочной кислоты[13].
Также молочная кислота используется в покрытии металлов, косметике, текстильной и кожевенной промышленности. Её эфиры находят применение в производстве красок и чернил, электроники и чистке металлов[13].
Безопасность
правитьМолочная кислота — это органическая карбоновая кислота, которая присутствует во многих организмах и является безопасной для окружающей среды. Увеличение производства молочной кислоты и, соответственно, полилактида оказывает положительное влияние тем, что вытесняет использование полимеров, производимых из нефти, снижает выбросы углекислого газа и предоставляет более широкие возможности по утилизации отходов[14].
Молочная кислота также используется в пищевой промышленности и не является токсичной. Тем не менее при попадании в глаза или на повреждённую кожу она вызывает раздражение. Полулетальная доза для крыс при оральном приёме составляет 3,73 г/кг[14].
См. также
правитьПримечания
править- ↑ 1 2 3 4 Ullmann, 2014, p. 1.
- ↑ rsl.ru. Дата обращения: 5 февраля 2020. Архивировано 5 февраля 2020 года.
- ↑ 1 2 Ullmann, 2014, p. 2.
- ↑ Трегер Ю. А. Молочная кислота // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 130—131. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- ↑ 1 2 3 4 5 Ullmann, 2014, p. 3.
- ↑ 1 2 3 Ullmann, 2014, p. 4.
- ↑ 1 2 3 Ullmann, 2014, p. 6.
- ↑ Dr. George A. Brooks Архивная копия от 5 сентября 2008 на Wayback Machine (англ.)
- ↑ George A. Brooks. What does glycolysis make and why is it important? // Journal of Applied Physiology. — 2010. — Вып. 108, № 6. — С. 1450-1451. — doi:10.1152/japplphysiol.00308.2010.
- ↑ Надежда Маркина. Старость заполняет мозг солями молочной кислоты. Infox.ru (7 ноября 2010). Дата обращения: 7 ноября 2010. Архивировано 23 августа 2011 года.
- ↑ Handbuch der Lebensmittelchemie. — Springer, 1935. — Vol. 2. Allgemeine Untersuchungsmethoden. Zweiter Teil: Chemische und Biologische Methoden. — С. 1099. — ISBN 9783662019481.
- ↑ Uffelmann: Pharmazeutische Zentralhalle für Deutschland. 1887, 28, 582.
- ↑ 1 2 3 4 Ullmann, 2014, p. 5.
- ↑ 1 2 Ullmann, 2014, p. 7.
Литература
править- Starr J. N., Westhoff G. Lactic Acid (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2014. — doi:10.1002/14356007.a15_097.pub3.
- Graham D. Lamb and D. George Stephenson. Point:Counterpoint: Lactic acid accumulation is an advantage/disadvantage during muscle activity // Journal of Applied Physiology. — 2006. — Вып. 100, № 4. — С. 1410-1412. — doi:10.1152/japplphysiol.00023.2006.
- ГОСТ 490-2006 Кислота молочная пищевая. Технические условия
Ссылки
править- ИК-спектр в конденсированной фазе. Sigma-Aldrich. Дата обращения: 1 апреля 2019.
- Спектр КР. Sigma-Aldrich. Дата обращения: 1 апреля 2019.