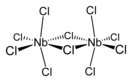
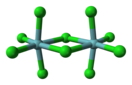
Хлорид ниобия(V) (пентахлорид ниобия) — это бинарное неорганическое химическое твердое кристаллическое вещество чаще всего желтого цвета. Является солью соляной кислоты и ниобия. Химическая формула NbCl5.
| Хлорид ниобия(V) | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Хлорид ниобия(V), пентахлорид ниобия | ||
| Хим. формула | NbCl5 | ||
| Физические свойства | |||
| Состояние | Желтые игольчатые кристаллы | ||
| Молярная масса | 270.17 г/моль | ||
| Плотность | 2,75 г/см³ | ||
| Энергия ионизации | 10,97 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 204.7 °C | ||
| • кипения | 254[1] °C | ||
| • вспышки | негорюч °C | ||
| Энтальпия | |||
| • образования | -797.47 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | разлагается | ||
| • в остальных веществах | растворим в спирте, HCl, хлороформе, CCl4, тетрахлорметане, сероуглероде, серной кислоте, эфире, уксусной кислоте | ||
| Структура | |||
| Кристаллическая структура | Тригональная бипирамидальная | ||
| Классификация | |||
| Рег. номер CAS | 10026-12-7 | ||
| PubChem | 24818 и 10199297 | ||
| Рег. номер EINECS | 233-059-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | QU0350000 | ||
| ChemSpider | 23203 и 8374796 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Структура и свойства
правитьХлорид ниобия(V) гигроскопичен, легко гидролизуется.
В твердом состоянии пентахлорид ниобия является димером с «мостиковыми» атомами хлора (см. изображение), то есть реальная молекула имеет формулу Nb2Cl10. Каждый ниобий окружен шестью ионами хлора, но октаэдрическая координация существенно искажена (см. структурное изображение).
Длины экваториальных связей Nb—Cl равны 0,225 нм (терминальная) и 0,256 нм (мостиковая), соответственно. Длина внеплоскостной связи ниобий—хлор равна 0,2292 нм и она образует с экваториальной плоскостью молекулы угол в 83,7°. «Мостиковый» угол Nb—Cl—Nb равен 101,3°. Два атома хлора выступают в качестве «мостикового» лиганда. Расстояние между атомами Nb равно 0,3988 нм, что указывает на отсутствие взаимодействия между металлическими центрами.NbBr5, TaCl5 и TaBr5 изоструктурны по отношению к пентахлориду ниобия, но NbI5 и TaI5 имеют разные структуры.
Получение
правитьНиобия пентахлорид получается прямым хлорированием металлического ниобия при температуре от 300 до 350 °C:
Также получают нагреванием смеси Nb2O5 с углем в токе хлора:
Может быть получен путём хлорирования пентаоксида ниобия в присутствии углерода при 300 °C. Полученные вещества содержат небольшое количество трихлороксида ниобия (NbOCl3).
Пентахлорид ниобия может быть очищен от примесей, оставшихся после реакций с помощью сублимации. Может быть получен хлорированием ниобия, ферросплавов ниобия, а также танталит-колумбитового сырья.[3]
Использование
правитьСоединение используется в органической химии как кислота Льюиса в активизации алкенов для карбонильных реакций и реакции Дильса-Альдера. Ниобия хлорид может генерировать n-ацилиминиевые соединения из определенных пирролидинов, которые являются субстратами для нуклеофилов, таких, например, как аллилтриметилсилан, индол, или силиловый эфир енола из бензофенона.
Пентахлорид ниобия используется в качестве исходного материала в химическом производстве для получения чистого ниобия.
Примечания
править- ↑ Важнейшие соединения ниобия. Дата обращения: 3 апреля 2010. Архивировано из оригинала 3 мая 2006 года.
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Патенты Российской Федерации (недоступная ссылка — история). Дата обращения: 3 апреля 2010.