Реакция Робинсона — Шёпфа
Реакция Робинсона-Шепфа — метод синтеза тропинонов и их гомологов конденсацией дикарбонильных соединений с ацетондикарбоновой кислотой и первичными аминами.
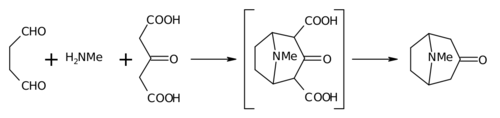
Разработан Робинсоном в 1917 г. как метод синтеза тропинона конденсацией диальдегида янтарной кислоты с ацетондикарбоновой кислотой и метиламином[1] в рамках его работ по механизмам синтеза алкалоидов тропанового ряда[2]:
Метод модифицирован в 1937 г. Шепфом[3].
Механизм
правитьРеакция Робинсона-Шепфа является модификацией реакции Манниха, в которой циклическая иминиевая соль, образующаяся из янтарного диальдегида, алкилирует енольную форму ацетондикарбоновой кислоты:
На первой стадии происходит конденсация альдегида с амином с образованием шиффова основания (1), которое затем претерпевает циклоконденсацию в иминиевую соль (2).
Иминиевая соль, в свою очередь, атакует C-нуклеофильный центр енола ацетондикарбоновой кислоты с образованием основания Манниха (3).
2-Гидроксипиррольный фрагмент основания Манниха затем дегидратируется с образованием иминиевой соли (4), после чего происходит внутримолекулярная конденсация Манниха, в которой C-электрофильный иминиевый фрагмент атакует C-нуклеофильный центр енола (5) с замыканием пиперидинового фрагмента тропана.
Модификации
правитьВ первоначальном варианте, описанном Робинсоном, реакция проводилась в присутствии щелочи, выходы при этом были невелики, ~20 %, однако Шепф модифицировал условия реакции, проводя синтез в условиях, близких к физиологическим — при комнатной температуре и в присутствии буфера (при pH ~5.5).
В современном варианте реакцию обычно проводят в водном растворе, при этом к раствору смеси ацетондикарбоновой кислоты и амина, буферизованном дигидрофосфатом или цитратом натрия, прибавляют раствор диальдегида или другого дикарбонильного соединения, после чего реакционную смесь выдерживают при комнатной температуре[4]. При необходимости декарбоксилирования первоначального продукта конденсации, реакционную смесь подкисляют соляной кислотой и проводят декарбоксилирование нагревом на паровой бане. В этих условиях выходы достигают 50-90 %[5],[4].
Реакция идет и при использовании гомологов янтарного диальдегида, при этом образуются гомологи тропинона, так, используя глутарового альдегида вместо янтарного, Мензис и Робинсон синтезировали алкалоид граната псевдопельтьерин[6].
В качестве синтетических аналогов дикарбонильных соединений могут использоваться их циклические ацетали — 2,5-диалкокситетрагидро- и 2,5-алкоксидигидрофураны вместо янтарного диальдегида и его гидроксипроизводного[7],[8] 2-этокси-3,4-дигидро-2H-пиран[5] и т. п.
При проведении реакции с ацетондикарбоновой кислотой, как правило, происходит декарбоксилирование промежуточно образующихся при замыкании цикла дикарбоксильных производных, для сохранения карбоксильных фрагментов применяют защиту карбоксильных групп, вводя в реакцию эфиры ацетондикарбоновой кислоты. Так, например, при синтезе 2-карбометокситропинона, предшественника метилового эфира экгонина, использующегося в полном синтезе кокаина, в реакцию вводят моноэфир ацетондикарбоновой кислоты[4].
Синтетическое значение
правитьРеакция Робинсона-Шепфа является первым примером сочетания ретросинтетического анализа и биомиметического подхода в планировании органического синтеза. Исследуя возможные пути биосинтеза тропановых алкалоидов, Робинсон, проанализировав структуру тропинона, пришел к выводу, что его «воображаемый гидролиз» может идти с образованием янтарного диальдегида, метиламина и ацетона — и предположил, что стратегия синтеза может быть обратной по отношению к «воображаемому гидролизу» — а именно, конденсацией этих фрагментов[1].
Эта гипотеза нашла блестящее экспериментальное подтверждение — используя ацетондикарбоновую кислоту как синтетический єквивалент ацетона с повышенной нуклеофильностью метиленовых групп, Робинсон синтезировал тропинон, ключевой предшественник в синтезе экгонина — структурной основы тропановых алкалоидов. Сама методика Робинсона — проведение одностадийного синтеза, в ходе которого осуществляется последовательность нескольких реакций, ведущих к хорошему выходу целевого продукта, в дальнейшем получила название one-pot synthesis.
Реакция используется как метод синтеза полициклических гетероциклов (аминодиальдегиды), пиперидинового цикла (при использовании глутарового альдегида — синтезы лобеланина[9], пиперидонов[10], оксазолопиперидинов и дальнейшего синтеза из них кониина[11],[12] гидроазуленов[13], беталаинов[14].
Примечания
править- ↑ 1 2 Robinson, Robert. LXIII.—A synthesis of tropinone (англ.) // Journal of the Chemical Society[англ.] : journal. — Chemical Society, 1917. — 1 January (vol. 111, no. 0). — P. 762—768. — ISSN 0368-1645. — doi:10.1039/CT9171100762. Архивировано 22 декабря 2015 года.
- ↑ Robinson, Robert. LXXV.—A theory of the mechanism of the phytochemical synthesis of certain alkaloids (англ.) // Journal of the Chemical Society[англ.] : journal. — Chemical Society, 1917. — 1 January (vol. 111, no. 0). — P. 876—899. — ISSN 0368-1645. — doi:10.1039/CT9171100876. Архивировано 22 декабря 2015 года.
- ↑ C. Schöpf, Angew. Chem. 50, 779, 797 (1937)
- ↑ 1 2 3 Casale, John F. A practical total synthesis of cocaine's enantiomers (англ.) // Forensic Science International[англ.] : journal. — 1987. — 1 January (vol. 33, no. 4). — P. 275—298. — ISSN 0379-0738. — doi:10.1016/0379-0738(87)90109-5.
- ↑ 1 2 PSEUDOPELLETIERINE (англ.) // Organic Syntheses[англ.] : journal. — 1957. — Vol. 37. — P. 73. — ISSN 23333553 00786209, 23333553. — doi:10.15227/orgsyn.037.0073. Архивировано 22 декабря 2015 года.
- ↑ Menzies, Robert Charles; Robinson, Robert. CCLXXXVI.—A synthesis of ψ-pelletierine (англ.) // Journal of the Chemical Society[англ.] : journal. — Chemical Society, 1924. — 1 January (vol. 125, no. 0). — P. 2163—2168. — ISSN 0368-1645. — doi:10.1039/CT9242502163. Архивировано 22 декабря 2015 года.
- ↑ N. Elming, in R. A. Raphael, E. C. Taylor, and H. Wynberg, "Advances in Organic Chemistry, " Vol. 2, 1960, pp. 67-115.
- ↑ The Alkaloids: Chemistry and Pharmacology V33: Chemistry and Pharmacology (англ.). — Academic Press, 1988. — P. 33—34. — ISBN 978-0-08-086557-7.
- ↑ Wieland H, Schopf C, Hermsen W. Liebigs Ann. Chem. 1925;444:40-68
- ↑ Langlois, Michel; Yang, Donglaï; Soulier, Jean-Louis; Florac, Claudie. Synthesis of Derivatives of 1, 2, 6-Trisubstttuted-4-Piperidones (англ.) // Synthetic communications : journal. — 1992. — Vol. 22, no. 21. — P. 3115—3127.
- ↑ Rubiralta, M.; Giralt, E.; Diez, A. Piperidine: Structure, Preparation, Reactivity, and Synthetic Applications of Piperidine and its Derivatives (англ.). — Elsevier, 2013. — P. 272. — ISBN 978-1-4832-9093-5.
- ↑ Guerrier, Luc; Royer, Jacques; Grierson, David S.; Husson, Henri Philippe. Chiral 1,4-dihydropyridine equivalents: a new approach to the asymmetric synthesis of alkaloids. The enantiospecific synthesis of (+)- and (-)-coniine and dihydropinidine (англ.) // Journal of the American Chemical Society[англ.] : journal. — 1983. — Vol. 105, no. 26. — P. 7754—7755. — ISSN 0002-7863. — doi:10.1021/ja00364a053.
- ↑ Chapman, O. L.; Koch, T. H. A Synthetic Entry to the Hydroazulenes. 4,5-Trimethylenetropone (англ.) // The Journal of Organic Chemistry[англ.] : journal. — 1966. — Vol. 31, no. 4. — P. 1042—1045. — ISSN 0022-3263. — doi:10.1021/jo01342a013.
- ↑ Buchi, George; Fliri, Hans; Shapiro, Rafael. Synthesis of betalains (англ.) // The Journal of Organic Chemistry[англ.] : journal. — 1978. — Vol. 43, no. 25. — P. 4765—4769. — ISSN 0022-3263. — doi:10.1021/jo00419a013.