Нитронаты — органические соединения, в которых присутствует функциональная группа =N+(O−)(O−), представляющая собой таутомерную форму нитро-группы −NO2. Общая формула нитронатов R1R2C=N+(OX)(O−). Если X = H, нитронаты обычно называют нитроновыми кислотами; существуют также нитроновые соли (X = металл), нитроновые эфиры (X = углеводородный радикал) и т.д.
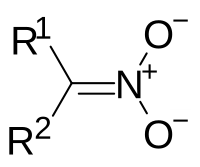
По сути, нитронаты являются аци-формой первичных и вторичных нитросоединений:
Получение
правитьСуществует несколько общих способов получения нитронатов:
- алкилирование нитросоединений диазометаном и его производными:
- где X: −NO2, −CN, −COOCH3, −COCH3, −C6H5 и прочие электронно-донорные группы.
- алкилирование нитросоединений оксониевыми солями:
- взаимодействие вторичных нитросоединений с сильными электрофильными реагентами:
- синтез через серебряную соль тринитрометана:
- синтез с использованием триалкилсилильных производных:
Химические свойства
правитьВследствие своего строения нитронаты обладают высокой реакционной способностью. С другой стороны, они, как правило, довольно нестабильны, что требует особых условий для их хранения и использования в органическом синтезе.
Наиболее известной реакцией с участием нитронатов (2) (без их непосредственного выделения из реакционной смеси) является реакция Нефа — превращение нитроалканов (1) в альдегиды или кетоны (3), сопровождающееся выделением оксида диазота (4):
Среди других реакций:
- превращение в оксимы:
См. также
правитьПримечания
правитьЛитература
править- Nitrile Oxides, Nitrones & Nitronates in Organic Synthesis: Novel Strategies in Synthesis / Edited by Henry Feuer. — Second edition. — John Wiley & Sons, 2008. — 753 p. — ISBN 978-0-471-74498-6.
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |
