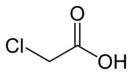
Монохлоруксусная кислота CH2ClCOOH — уксусная кислота, в которой один атом водорода метильной группы замещён на атом хлора, бесцветные кристаллы.
| Монохлоруксусная кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Хлорэтановая кислота | ||
| Традиционные названия | Монохлоруксусная кислота | ||
| Хим. формула | C2H3ClO2 | ||
| Физические свойства | |||
| Молярная масса | 94,50 г/моль | ||
| Плотность | 1.58 г/см³ | ||
| Энергия ионизации | 10,7 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 63 °C | ||
| • кипения | 189 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 2,87 | ||
| Классификация | |||
| Рег. номер CAS | 79-11-8 | ||
| PubChem | 300 | ||
| Рег. номер EINECS | 201-178-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | AF8575000 | ||
| ChEBI | 27869 | ||
| ChemSpider | 10772140 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м3 | ||
| ЛД50 | 76 мг/кг | ||
| Токсичность | Класс опасности II | ||
| Краткие характер. опасности (H) |
H301+H311+H331, H314, H335, H400 |
||
| Меры предостор. (P) |
P280, P301+P330+P331, P304+P340, P305+P351+P338, P308+P311 |
||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические свойства
правитьtпл 61,2 °C tкип 189,3 °C. Растворима в воде, спирте, ацетоне, эфире.
Применение
правитьМонохлоруксусная кислота — промежуточный продукт в синтезе индиго и многих др. кубовых красителей; её применяют также при получении карбоксиметилцеллюлозы, снотворного средства барбитала, гербицидов (например, солей и эфиров 2,4-дихлорфеноксиуксусной кислоты), витамина B6.
Иллюстрацией её полезности в органической химии является O-алкилирование салицилового альдегида хлоруксусной кислотой с последующим декарбоксилированием образовавшегося эфира, получая бензофуран. [2]
Большинство реакций используют высокую реакционную способность связи C-Cl. Она прекурсор для гербицида глифосата. Гербицид МХФУК(2-метил-4-хлорофенокси уксусная кислота) был получен алкилированием хлоруксусной кислотой. Хлоруксусную кислоту переводят в хлорацетилхлорид, прекурсор адреналина(эпинефри́на).
Замещение хлора серой даёт тиогликолевую кислоту, которая используется как стабилизатор ПВХ и иногда как компонент в косметике. Наибольшее количество хлоруксусной кислоты используется для приготовления загустителя — карбоксиметилцеллюлозы.
Получение
правитьВ основном получают монохлоруксусную кислоту хлорированием ледяной уксусной кислоты при катализе уксусным ангидридом:
Другой промышленный метод — гидролиз трихлорэтилена
Гидролиз даёт чистый продукт, тогда как при хлорировании необходимо проводить сложную дистилляцию для отделения моно- би- трихлоруксусных кислот[3].
Годовое производство хлоруксусной кислоты составляет ориентировочно 420 тыс. тонн.
При взаимодействии хлора с уксусной кислотой в присутствии небольшого количества красного фосфора, образуется смесь моно-, ди- и трихлоруксусной кислот.
Безопасность
правитьКак и другие галогенкислоты и галогеналканы, хлоруксусная кислота — потенциально опасный алкилирующий агент. ЛД50 на крысах 76 мг/кг
Примечания
править- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Burgstahler, A. W.; Worden, L. R. (1966). «Coumarone Архивная копия от 14 июня 2012 на Wayback Machine.» Org. Synth. 46: 28.
- ↑ Günter Koenig, Elmar Lohmar, Norbert Rupprich «Chloroacetic Acids» in Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_537
Литература
править- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.