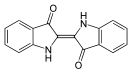
Инди́го (исп. índigo), 2-(1,3-дигидро-3-оксо-2H-индол-2-илиден)-1,2-дигидро 3H-индол-3-он, (δ2,2'-бииндолин)-3,3'-дион — кристаллы фиолетового цвета, малорастворимы в большинстве органических растворителей (слабо растворим в нитробензоле, хлороформе). Бесцветная и водорастворимая форма индиго (лейкоформа или белый индиго) используется как синий кубовый краситель. Лейкоформу получают путем восстановления в щелочах с формированием енола (кубование).
| Индиго | |||
|---|---|---|---|
| |||
| Общие | |||
| Традиционные названия | индиготин | ||
| Хим. формула | C16H10N2O2[1] | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 262.27 г/моль | ||
| Плотность | 1,199 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | +390…392 °C | ||
| Классификация | |||
| Рег. номер CAS | 482-89-3 | ||
| PubChem | 135436515 | ||
| Рег. номер EINECS | 207-586-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | DU2988400 | ||
| ChemSpider | 4477009 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Индиго является крупнотоннажным (потребляемым в больших количествах) продуктом, большая часть которого идёт на окраску волокна при производстве джинсовой ткани.
При сульфировании получается индигокармин, его применяют как окислительно-восстановительный индикатор для приготовления чернил, синьки, акварельных красок. Также широко известен 6,6'-диброминдиго, являющийся основным компонентом пурпура.
До конца XIX века индиго получали из растений индигоноски, подсемейства мотыльковых, преимущественно тропических — Indigofera tinctoria, Isatis tinctoria, Polygonium tinctorium и других, содержание красителя (глюкозид индикана) в которых достигало 0,5 % — листья, 0,2 % — стебли. В Средние века индигоносный Isatis tinctoria (вайда) культивировался также на юге России и в средней Германии, но выход красителя из этого сырья был значительно меньше, чем из тропического, что обусловило превалирование колониального товара на европейском рынке.
Для выделения красителя свежесрезанные растения помещают в ямы на 12-24 часа, заливая водой. Процесс брожения сопровождается выделением углекислоты, а носитель красителя переходит в раствор и окрашивает его в жёлтый цвет. Полученный раствор заливают в чаны, где при постоянном помешивании он соприкасается с кислородом воздуха, в результате чего образуется индиго, выпадающее в осадок хлопьями синего цвета. Полученную массу промывают, отжимают и формуют. В лучших сортах сырья содержание индиготина составляет 90 % (бенгальское), в худших — 10-15 % (вайда, эквадорское сырье).
Синтез
правитьМетоды синтеза индиго
правитьЧтобы преодолеть зависимость от Англии, ввозившей натуральный индиго из Индии, европейские химики стремились синтезировать краситель искусственно, разработав сотни методов его получения. Честь разработки первого метода получения индиго и изучения его химической формулы принадлежит Адольфу Байеру, впервые синтезировавшему индиго в 1870 году[2]. Основой для его опытов был изатин, при перегонке которого с цинковой пылью химик получил вещество, названное им индолом, из производного которого затем удалось выделить индиго. Поскольку само базовое вещество все-таки имело растительную основу, Байер продолжил свои опыты и в 1878 году получил искусственный изатин из фенилуксусной кислоты. Однако эта схема была дорогостоящей и малоэффективной, поэтому в 1880 году Байер предложил синтез индиго из производных фенилацетилена и в 1882 году, совместно с Древсеном — из орто-нитробензальдегида. Это подтолкнуло химиков к поискам методов коммерческого производства индиго, в чём преуспел швейцарец Карл Хойман, синтезировавший индиго из доступного производного анилина — антраниловой кислоты, уже широко применявшейся для синтеза анилиновых красителей, и из хлоруксусной кислоты, легко производимой из уксусной кислоты, производной ацетальдегида. По патенту Хоймана в 1897 году компания BASF, а в 1902 году компания Höchst начали массовое производство индиго. Таким образом цена индиго упала в несколько раз, и к началу Первой мировой войны синтетический индиго практически полностью вытеснил с рынка натуральный.
Промышленное производство
правитьОсновным промышленным методом синтеза индиго является синтез циклизацией N-(2-карбоксифенил)глицина по типу конденсации Клайзена с образованием индоксилата, который под действием кислорода воздуха окисляется до индиго:
В 750 мл круглодонную колбу с обратным холодильником помещают 14 г антраниловой кислоты, 10 г монохлоруксусной кислоты, 20 г безводного карбоната натрия и 200 мл воды. Смесь нагревают с обратным холодильником в течение 3 часов, затем переливают в мензурку, охлаждают, добавляют немного концентрированной соляной кислоты и оставляют на ночь. Неочищенную фенилглицин-о-карбоновую кислоту отфильтровывают и промывают водой. Продукт очищают перекристаллизацией из горячей воды, в которую добавлено некоторое количество активированного угля для удаления окрашенных примесей, после чего сушат при +100 °С. Полученная фенилглицин-о-карбоновая кислота имеет температуру плавления +208 °С, выход составляет 12 г.
В никелевый тигель (не реагирует с расплавленной щелочью) помещают смесь 10 г фенилглицин-о-карбоновой кислоты, 30 г шариков гидроксида натрия и 10 мл воды. Смесь нагревают до +200…210 °С, хорошо перемешивая её термометром, защищённым медным наконечником. Реакционная масса расплавляется и постепенно принимает оранжевую окраску. Когда смесь станет оранжевой, тиглю дают остыть и растворяют сплав в 200 мл воды. При тряске раствора при доступе воздуха продукт реакции окисляется, превращаясь в индиго. Превращение в индиго может быть ускорено добавлением соляной кислоты с последующим окислением раствора хлоридом железа. Окисление ведут до тех пор, пока из раствора не перестанет выпадать осадок индиго. Полученный индиго отсасывают на воронке Бюхнера, промывают водой и высушивают. Выход — 7 г.
Фильтрованный раствор индоксила можно окислять продуванием воздуха через раствор. Продувание ведут до тех пор, пока капля водной суспензии выделяющегося индиго при помещении между двумя листами фильтровальной бумаги не будет оставлять чёткое кольцо твёрдого индиго, а жидкость вокруг него при действии воздуха больше не будет синеть.
Примечания
править- ↑ Индиго // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)
- ↑ 1 2 Индиго. — Техническая энциклопедия. — Directmedia, 2013. — С. 57—63. — 493 с. — ISBN 978-5-4458-0574-8.
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.