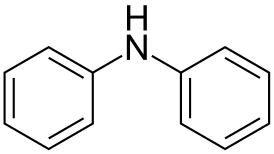
Дифенилами́н ((N-фенил)-анилин, анилинобензол) — органическое вещество с формулой (С6Н5)2NН. Также его называют N-фениламинобензолом.
| Дифениламин | |
|---|---|
   | |
| Общие | |
| Систематическое наименование |
Дифениламин |
| Традиционные названия | Дифениламин, анилинобензол |
| Хим. формула | (С6H5)2NH |
| Рац. формула | С12H11N |
| Физические свойства | |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 169,227 г/моль |
| Плотность | 1,0513 г/см³ |
| Энергия ионизации | 7,4 ± 0,1 эВ[1] и 7,16 эВ[2] |
| Термические свойства | |
| Температура | |
| • плавления | 54-55 °C |
| • кипения | 302 °C |
| • вспышки | 307 ± 1 ℉[1] |
| Энтальпия | |
| • сгорания | 6414,9 кДж/моль кДж/моль |
| • плавления | 17,86 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,03 г/100 мл |
| • в этаноле | 44 г/100 мл |
| • в метаноле | 57,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 122-39-4 |
| PubChem | 11487 |
| Рег. номер EINECS | 204-539-4 |
| SMILES | |
| InChI | |
| RTECS | JJ7800000 |
| ChEBI | 4640 |
| ChemSpider | 11003 |
| Безопасность | |
| Предельная концентрация | 10 мг/м³ |
| ЛД50 | 2 г/кг |
| Токсичность | По токсичности уступает анилину (фактор от 7 до 10). Средняя смертельная доза более 100 г. |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Физические свойства
правитьДифениламин представляет собой бесцветные кристаллы, темнеющие на свету.
Температура плавления 54-55 °C, температура кипения 302 °C,температура воспламенения 153 °C, температура самовоспламенения. 633 °C.
Удельная теплоёмкость составляет 1,412 Дж/(г*К) рКа 0,9 (25 °C, вода).
Легко растворим в диэтиловом эфире, бензоле, ацетоне, четырёххлористом углероде. Растворимость при 25 °C в 100 г этанола — 44 г, метанола — 57,5 г, воды — 0,03 г.
Химические свойства
правитьС концентрированными минеральными кислотами дифениламин образует соли, гидролизующиеся разбавленными кислотами и водой. Атом Н, связанный с N, может быть замещён на атом щелочного металла; замена его на алкил, арил или ацил происходит труднее, чем у анилина, например N-ацетилдифениламин образуется при ацетилировании дифениламин уксусным ангидридом в присутствии НClO4 при 80-100 °C.
Дифениламин легко нитрозируется при взаимодействии с HNO2 до N-нитрозодифениламина: нитруется значительно легче бензола до тринитропроизводных, галогенируется до тетра- и гексагалогенопроизводных, легко алкилируется в присутствии кислотных катализаторов в параположение.
Получение
правитьВ промышленности дифениламин получают взаимодействием эквимолярных количеств анилина с гидрохлоридом анилина (катализатор — HCl, AlCl3, NH4BF4 или другие) в автоклаве при 300 °C (выход 50-60 %):
или пропусканием паров анилина (400 °C) через Аl2О3, очищают фракционной перегонкой или перекристаллизацией из бутанола.
Применение
правитьДифениламин — исходный продукт в производстве антиоксидантов для полимеров; стабилизатор и флегматизатор термо- и атмосферостойкости нитратов целлюлозы, в том числе пироксилиновых порохов; промежуточный продукт в синтезе триарилметановых и азокрасителей, инсектицидов; ингибитор коррозии мягких сталей. Используется в аналитической химии для обнаружения ионов , , и других окислителей, как окислительно-восстановительный индикатор (Е0 = + 0,75 В).
Сведения о безопасности
правитьНижний КПВ 5 г/м3. ОБУВ для окр ср - 0,07 мг/м3, ЛД50 2,9 г/кг (белые мыши, перорально).
Примечания
править- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0240.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Для улучшения этой статьи желательно:
|
