Анаэробы (от греч. αν — отрицательная частица, греч. αέρ — «воздух» и греч. βιοζ — «жизнь») — организмы, получающие энергию при отсутствии доступа кислорода путём субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ.
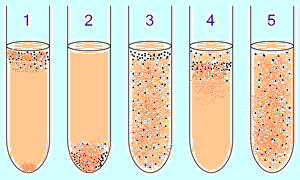
1. Облигатные аэробные бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода (исключение: микобактерии — рост плёнкой на поверхности из-за восколипидной мембраны).
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста).
3. Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является более выгодным, чем гликолиз), однако они могут быть найдены на всём протяжении среды, так как от O2 не зависят.
4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
5. Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Анаэробы — обширная группа организмов, как микро-, так и макроуровня:
- анаэробные микроорганизмы — обширная группа прокариотов и некоторые простейшие.
- макроорганизмы — грибы, водоросли, растения, фораминиферы и некоторые животные, такие как большинство гельминтов (сосальщики, ленточные черви, круглые черви (например, аскарида)), а также Henneguya salminicola из типа стрекающих.
Помимо этого, анаэробное окисление глюкозы играет важную роль в работе поперечно-полосатой мускулатуры животных и человека (особенно в состоянии тканевой гипоксии).
Термин «анаэробы» ввёл Луи Пастер, открывший в 1861 году бактерии маслянокислого брожения. Анаэробное дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов при использовании в качестве конечного акцептора электронов не кислорода, а других веществ (например, нитратов) и относится к процессам энергетического обмена (катаболизм, диссимиляция), которые характеризуются окислением углеводов, липидов и аминокислот до низкомолекулярных соединений.
Степень аэробности среды
правитьДля измерения потенциала среды М. Кларк предложил использовать величину pH20 — отрицательный логарифм парциального давления газообразного водорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10][2].
Классификация анаэробов
правитьСогласно устоявшейся в микробиологии классификации, различают:
- Факультативные анаэробы
- Капнеистические анаэробы и микроаэрофилы
- Аэротолерантные анаэробы
- Умеренно-строгие анаэробы
- Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам[3].
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа — B. abortus)[2].
Умеренно-строгий анаэробный организм выживает в среде с молекулярным O2, однако не размножается. Микроаэрофилы способны выживать и размножаться в среде с низким парциальным давлением O2.
Если организм не способен «переключиться» с анаэробного типа дыхания на аэробный, но не гибнет в присутствии молекулярного кислорода, то он относится к группе аэротолерантных анаэробов. Например, молочнокислые и многие маслянокислые бактерии.
Облигатные анаэробы в присутствии молекулярного кислорода O2 гибнут — например, представители рода бактерий и архей: Bacteroides, Fusobacterium, Butyrivibrio, Methanobacterium). Такие анаэробы постоянно живут в лишённой кислорода среде. К облигатным анаэробам относятся некоторые бактерии, дрожжи, жгутиковые и инфузории.
Токсичность кислорода и его форм для анаэробных организмов
правитьСреда с содержанием кислорода является агрессивной по отношению к органическим формам жизни. Это связано с образованием активных форм кислорода в процессе жизнедеятельности или под действием различных форм ионизирующего излучения, значительно более токсичных, чем молекулярный кислород O2. Фактор, определяющий жизнеспособность организма в среде кислорода[4] — наличие у него функциональной антиоксидантной системы, способной к элиминации: супероксид-аниона(O2−), пероксида водорода(H2O2), синглетного кислорода(1O2), а также молекулярного кислорода (O2) из внутренней среды организма. Наиболее часто подобная защита обеспечивается одним или несколькими ферментами:
- супероксиддисмутаза, элиминирующая супероксид-анион(O2−) без энергетической выгоды для организма
- каталаза, элиминирующая перекись водорода(H2O2) без энергетической выгоды для организма
- цитохром — фермент, отвечающий за перенос электронов от NAD•H к O2. Этот процесс обеспечивает существенную энергетическую выгоду организму.
Аэробные организмы содержат чаще всего три цитохрома, факультативные анаэробы — один или два, облигатные анаэробы не содержат цитохромов.
Анаэробные микроорганизмы могут активно воздействовать на среду[2] , создавая подходящий окислительно-восстановительный потенциал среды (например, Clostridium perfringens). Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH20 с величины [20-25] до [1-5], ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH20[5].
Дополнительная антиоксидантная защита может обеспечиваться синтезом или накоплением низкомолекулярных антиоксидантов: витамина С, А, E, лимонной и других кислот.
Получение энергии путём субстратного фосфорилирования. Брожение. Гниение
править- Также анаэробные организмы могут получать энергию путём катаболизма аминокислот и их соединений (пептидов, белков). Такие процессы именуют гниением, а микрофлору в энергетическом обмене которой преобладают процессы катаболизма аминокислот называют гнилостной.
- Анаэробные микроорганизмы расщепляют гексозы (например, глюкозу) разными путями:
- Гликолиз (Путь Эмдена-Мейергофа) после которого продукт подвергается брожению
- окислительный пентозофосфатный путь (другие названия: Фосфогликонатный путь, иначе гексозомонофосфатный(ГКМ), иначе путь Варбурга — Диккенса — Хореккера)
- Путь Энтнера — Дудорова (особенно значимый, когда субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные)
В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis. Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчёркивает неоднородность эубактерий, объединённых в эту таксономическую группу[6].
При этом характерным только для анаэробов является гликолиз, который в зависимости от конечных продуктов реакции разделяют на несколько типов брожения:
- молочнокислое брожение — род Lactobacillus, Streptococcus, Bifidobacterium, а также некоторые ткани многоклеточных животных и человека.
- спиртовое брожение — сахаромицеты, кандида (организмы царства грибов)
- муравьинокислое — семейство энтеробактерий
- маслянокислое — некоторые виды клостридий
- пропионовокислое — пропионобактерии(например, Propionibacterium acnes)
- брожение с выделением молекулярного водорода — некоторые виды клостридий, ферментация Stickland
- метановое брожение — например, Methanobacterium
В результате расщепления глюкозы расходуется 2 молекулы, а синтезируется 4 молекулы АТФ. Таким образом общий выход АТФ составляет 2 молекулы АТФ и 2 молекулы НАД·Н2. Полученный в ходе реакции пируват утилизируется клеткой по-разному в зависимости от того, какому типу брожения она следует.
Антагонизм брожения и гниения
правитьВ процессе эволюции сформировался и закрепился биологический антагонизм бродильной и гнилостной микрофлоры:
Расщепление микроорганизмами углеводов сопровождается значительным снижением pH среды, в то время как расщепление белков и аминокислот — повышением (защелачиванием). Приспособление каждого из организмов к определённой реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Культивирование анаэробных организмов
правитьКультивирование анаэробных организмов в основном является задачей микробиологии.
Сложнее дело обстоит с культивированием анаэробных многоклеточных организмов, поскольку для их культивирования часто необходима специфическая микрофлора, а также определённые концентрации метаболитов. Применяется, например, при исследовании паразитов человеческого организма.
Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его специализированной газовой смесью (или инертными газами) в герметизированных термостатах — анаэростатах[7].
Другим способом выращивания анаэробов(чаще всего микроорганизмов) на питательных средах — добавление редуцирующих веществ (глюкозу, муравьинокислый натрий, казеин, сульфат натрия, тиосульфат, цистеин, тиогликолят натрия и др.), связывающих токсичные для анаэробов перекисные соединения.
Общие питательные среды для анаэробных организмов
правитьДля общей среды Вильсона-Блера базой является агар-агар с добавлением глюкозы, сульфита натрия и двуххлористого железа. Клостридии образуют на этой среде колонии чёрного цвета за счёт восстановления сульфита до сульфид-аниона, который, соединяясь с катионами железа (II), даёт соль чёрного цвета. Как правило, чёрные на этой среде образования колонии появляются в глубине агарового столбика[8].
Среда Китта-Тароцци состоит из мясопептонного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20—30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
Общие методы культивирования для анаэробных организмов
правитьGasPak — система химическим путём обеспечивает постоянство газовой смеси, приемлемой для роста большинства анаэробных микроорганизмов. В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
Данный метод был предложен Брюером и Олгаером в 1965 году. Разработчики представили одноразовый пакет, генерирующий водород, который был позднее усовершенствован ими до саше, генерирующих двуокись углерода и содержащих внутренний катализатор[9][10].
Метод Цейсслера применяется для выделения чистых культур спорообразующих анаэробов. Для этого производят посев на среду Китт-Тароцци, прогревают 20 мин при 80 °C (для уничтожения вегетативной формы), заливают среду вазелиновым маслом и инкубируют 24 ч в термостате. Затем производят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования интересующие колонии изучаются — их пересеивают на среду Китт-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Фортнера — посевы производят на чашку Петри с утолщённым слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной.
Метод Вейнберга используется для получения чистых культур облигатных анаэробов. Культуры, выращенные на среде Китта-Тароцци, переносят в сахарный бульон. Затем одноразовой пастеровской пипеткой материал переносят в узкие пробирки (трубки Виньяля) с сахарным мясо-пептонным агаром, погружая пипетку до дна пробирки. Засеянные пробирки быстро охлаждают, что позволяет фиксировать бактериальный материал в толще затвердевшего агара. Пробирки инкубируют в термостате, а затем изучают выросшие колонии. При обнаружении интересующей колонии на её месте делают распил, материал быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Перетца — в расплавленный и охлаждённый сахарный агар-агар вносят культуру бактерий и заливают под стекло, помещённое на пробковых палочках(или фрагментах спичек) в чашку Петри. Метод наименее надёжен из всех, но достаточно прост в применении.
Дифференциально — диагностические питательные среды
править- Среды Гисса («пёстрый ряд»)
- Среда Ресселя (Рассела)
- Среда Эндо
- Среда Плоскирева или бактоагар «Ж»
- Висмут-сульфитный агар
Среды Гисса: К 1 % пептонной воде добавляют 0,5 % раствор определённого углевода (глюкоза, лактоза, мальтоза, маннит, сахароза и др.) и кислотно-щелочной индикатор Андреде, разливают по пробиркам, в которые помещают поплавок для улавливания газообразных продуктов, образующихся при разложении углеводородов.
Среда Ресселя (Рассела) применяется для изучения биохимических свойств энтеробактерий(шигелл, сальмонелл). Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий). Цвет среды травянисто-зелёный. Обычно готовят в пробирках по 5 мл со скошенной поверхностью. Посев осуществляют уколом в глубину столбика и штрихом по скошенной поверхности.
Среда Плоскирева (бактоагар Ж) — дифференциально-диагностическая и селективная среда, поскольку подавляет рост многих микроорганизмов, и способствует росту патогенных бактерий (возбудителей брюшного тифа, паратифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные. В составе среды — агар, лактоза, бриллиантовый зелёный, соли жёлчных кислот, минеральные соли, индикатор (нейтральный красный).
Висмут-сульфитный агар предназначен для выделения сальмонелл в чистом виде из инфицированного материала. Содержит триптический гидролизат, глюкозу, факторы роста сальмонелл, бриллиантовый зелёный и агар. Дифференциальные свойства среды основаны на способности сальмонелл продуцировать сероводород, на их устойчивости к присутствию сульфида, бриллиантового зелёного и лимоннокислого висмута. Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона-Блера).
Метаболизм анаэробных организмов
правитьМетаболизм анаэробных организмов имеет несколько различных подгрупп:
- Организмы способные использовать анаэробное дыхание (другие окислители — серу, азот (см. Анаэробное дыхание), хлораты, перхлораты, хроматы и перманганаты[11]);
- Использующие циклическое фотосинтетическое фосфорилирование (лучевую энергию (чаще всего Солнца)) — фототрофные анаэробы (см. также Аноксигенный фотосинтез);
- Организмы, энергетический обмен которых опирается на катаболизм высокомолекулярных/высокоэнергетических соединений (например, гликолиз).
Анаэробный энергетический обмен в тканях человека и животных
правитьНекоторые ткани животных и человека отличаются повышенной устойчивостью к гипоксии (особенно мышечная ткань). В обычных условиях синтез АТФ идёт аэробным путём, а при напряжённой мышечной деятельности, когда доставка кислорода к мышцам затруднена, в состоянии гипоксии, а также при воспалительных реакциях в тканях доминируют анаэробные механизмы регенерации АТФ. В скелетных мышцах выявлены 3 вида анаэробных и только один аэробный путь регенерации АТФ.
К анаэробным относятся:
- Креатинфосфатазный (фосфогеный или алактатный) механизм — перефосфорилирование между креатинфосфатом и АДФ
- Миокиназный — синтез (иначе ресинтез) АТФ при реакции трансфосфорилирования 2 молекул АДФ (аденилатциклаза)
- Гликолитический — анаэробное расщепление глюкозы крови или запаса гликогена, заканчивающийся образованием молочной кислоты (иначе именуется «лактатным»).
Прямым следствием гликолиза является критическое снижение рН тканей — ацидоз. Это ведёт к снижению эффективного транспорта кислорода гемоглобином, и формирует положительную обратную связь.
Каждый механизм имеет своё время удержания максимальной мощности и оптимум энергообеспечения тканей. Наибольшая мощность и наименьшее время удержания:
- креатинфосфаткиназный механизм (3600 Дж/(кг·мин), при времени 6—12 сек)
- лактатный (2510 Дж/(кг·мин), при времени 30—60 сек)
- аэробный (600 Дж/(кг·мин), при времени около 600 секунд).
См. также
правитьПримечания
править- ↑ Газогенерирующие контейнерные системы GasPak: Инструкция МК. — OOO "МК, официальный дистрибьютер Becton Dickinson International", 2010. — С. 7.
- ↑ 1 2 3 К. Д. Пяткин. Микробиология с вирусологией и иммунологией. — М:"Медицина", 1971. — С. 56.
- ↑ Л. Б. Борисов. Медицинская микробиология, вирусология и иммунология. — МИА, 2005. — С. 154—156. — ISBN 5-89481-278-X.
- ↑ Д. Г. Кнорре. Биологическая химия: Учеб. для хим., биол. и мед. спец. вузов. — 3. — М.: Высшая школа, 2000. — С. 134. — ISBN 5-06-003720-7.
- ↑ D. A. Eschenbach, P. R. Davick, B. L. Williams. Prevalence of hydrogen peroxide-producing Lactobacillus species in normal women and women with bacterial vaginosis. — J Clin Microbiol. 1989 February; 27(2): 251–256.
- ↑ М. В. Гусев, Л. А. Минеева. Микробиология. — М:МГУ, 1992. — С. 56.
- ↑ Воробьёв А. А. Атлас по медицинской микробиологии, вирусологии и иммунологии. — МИА, 2003. — С. 44. — ISBN 5-89481-136-8.
- ↑ Л. Б. Борисов. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. — Медицина, 1992. — С. 31—44. — ISBN 5-2225-00897-6.
- ↑ J. H. Brewer, D. L. Allgeier. Disposable hydrogen generator. — Science 147:1033-1034. — 1966.
- ↑ J. H. Brewer, D. L. Allgeier. Safe self-contained carbon dioxide-hydrogen anaerobic system. — Appl. Microbiol.16:848-850. — 1966.
- ↑ G. F. Smirnova. Metabolism peculiarities of bacteria restoring chlorates and perchlorates. — Microbiol Z. 2010 Jul-Aug;72(4):22-8.
- ↑ Филиппович Ю. Б., Коничев А. С., Севастьянова Г. А. Биохимические основы жизнедеятельности организма человека. — Владос, 2005. — С. 302. — ISBN 5-691-00505-7.
Ссылки
править- Анаэробии (анаэробы) // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Анаэробы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.