Креатинфосфорная кислота
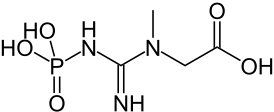
Креатинфосфорная кислота (креатинфосфат, фосфокреатин) — 2-[метил-(N'-фосфонокарбоимидоил)амино]уксусная кислота. Бесцветные кристаллы, растворимые в воде, легко гидролизуется с расщеплением фосфамидной связи N-P в кислой среде, устойчива в щелочной.
| Креатинфосфорная кислота | |
|---|---|
 | |
| Общие | |
| Хим. формула | C4H10N3O5P |
| Физические свойства | |
| Молярная масса | 211,113 г/моль |
| Классификация | |
| Рег. номер CAS | 67-07-2 |
| PubChem | 9548602, 587 и 5359254 |
| Рег. номер EINECS | 200-643-9 |
| SMILES | |
| InChI | |
| ChEBI | 17287 |
| ChemSpider | 567 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Кислота была открыта[1][2] Филиппом и Грейс Эгглтонами из Кембриджского университета[3] и независимо Сайрусом Фиске и Йеллапрагадой Суббарао из Гарвардской медицинской школы[4] в 1927 году.
Лабораторный синтез — фосфорилирование креатина POCl3 в щелочной среде.
Креатинфосфат — продукт обратимого метаболического N-фосфорилирования креатина, являющийся, подобно АТФ, высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, креатинфосфат гидролизуется по фосфамидной связи N-P, что обуславливает значительно больший энергетический эффект реакции. Так, при гидролизе изменение свободной энергии для креатина G0~ −43 кДж/моль, в то время как при гидролизе АТФ до АДФ G0~ −30.5 кДж/моль.
Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования:
- креатинфосфат + АДФ ⇔ креатин + АТФ
Эта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе (и, соответственно, падении концентрации) АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается вправо, что ведёт к восстановлению нормальной концентрации АТФ.
Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход АТФ во время кратких периодов мышечной активности, в период покоя при отсутствии мышечной активности в ткани идёт гликолиз и окислительное фосфорилирование АДФ в АТФ, в результате чего равновесие реакции смещается влево и концентрация креатинфосфата восстанавливается.
В тканях креатинфосфат подвергается самопроизвольному неферментативному гидролизу с циклизацией в креатинин, выводящийся с мочой, уровень выделения креатинина зависит от состояния организма, меняясь при патологических состояниях, и является диагностическим признаком.
Креатинфосфат является одним из фосфагенов — N-фосфорилированных производных гуанидина, являющихся энергетическим депо, обеспечивающим быстрый синтез АТФ. Так, у многих беспозвоночных (например, насекомых) роль фосфагена играет аргининфосфорная кислота, у некоторых кольчатых червей — N-фосфоломбрицин.
Примечания
править- ↑ Molecular system bioenergetics: energy for life (неопр.). — Weinheim: Wiley-VCH, 2007. — С. 2. — ISBN 978-3-527-31787-5.
- ↑ Ochoa, Severo. David Nachmansohn (неопр.) / Sherman, E. J.; National Academy of Sciences. — National Academies Press[англ.], 1989. — Т. 58. — С. 357—404. — (Biographical Memoirs). — ISBN 978-0-309-03938-3.
- ↑ Eggleton, Philip; Eggleton, Grace Palmer. The inorganic phosphate and a labile form of organic phosphate in the gastrocnemius of the frog (англ.) // Biochemical Journal[англ.] : journal. — 1927. — Vol. 21, no. 1. — P. 190—195. — PMID 16743804. — PMC 1251888. Архивировано 30 мая 2020 года.
- ↑ Fiske, Cyrus H.; Subbarao, Yellapragada. The nature of the 'inorganic phosphate' in voluntary muscle (англ.) // Science : journal. — 1927. — Vol. 65, no. 1686. — P. 401—403. — doi:10.1126/science.65.1686.401. — PMID 17807679. Архивировано 17 октября 2009 года.
См. также
правитьЛитература
править- Креатинфосфорная кислота (формула) — статья из Большой советской энциклопедии.
Это заготовка статьи по биохимии. Помогите Википедии, дополнив её. |