НАДФH-оксидаза, или NADPH-оксидаза (NOX) — клеточный мембрано-связанный мультимолекулярный ферментный комплекс, локализующийся на плазматической мембране и в некоторых органеллах. Особенно обогащены этим ферментом фагоцитарные клетки, такие как макрофаги. Эти оксидазы участвуют в клеточной противомикробной защитной системе, а также в клеточной пролиферации, дифференцировке и регуляции экспрессии генов. Существует целая группа НАДФH-оксидаз, которые различаются по составу субъединиц, клеточной специфичности, регуляции и другим параметрам.
| НАДФH-оксидаза | |
|---|---|
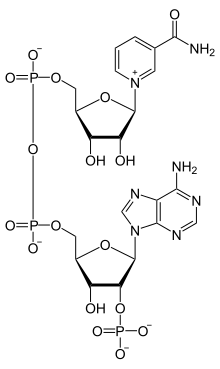 Химическая формула НАДФ+ | |
| Идентификаторы | |
| Шифр КФ | 1.6.3.1 |
Реакция
правитьРеакция, катализируемая НАДФH-оксидазой, заключается в окислении НАДФ•H до НАДФ+ внутри клетки с переносом электронов на другую сторону клеточной мембраны и образованию на наружной стороне клетки супероксидного радикала из кислорода среды.
НАДФ•H (внутриклеточный) + 2 O2 (внеклеточный) → НАДФ+ (внутриклеточный) + H+ (внутриклеточный) + 2 O2•- (внеклеточный)
Классификация
править| Тип НАДФH-оксидазы | Регуляторные белки и субъединицы | Механизм активации | Экспрессия в клетках (в лёгких) |
|---|---|---|---|
| NOX1 (NOH-1, MOX1) | p22phox, NOXO1, NOXA1, Rac1 | ? | эпителиальные клетки |
| NOX2 (gp91phox) | p22phox, p47phox (NOXO2), p67phox (NOXA2), p40phox, Rac1/Rac2 | Ca2+, фосфорилирование | миелоидные клетки (макрофаги, дендритные клетки), эндотелиальные клетки, гладкомышечные клетки, фибробласты |
| NOX3 | p22phox, NOXO1 | ? | эпителий вестибулярного аппарата |
| NOX4 (RENOX) | p22phox | Конститутивно активная | эндотелиальные клетки, гладкомышечные клетки, фибробласты |
| DUOX1 (Thox1, LNOX1) | DUOXA1 | Ca2+, фосфорилирование | эпителиальные клетки, лимфоциты (?) |
| DUOX2 (Thox2, LNOX2) | DUOXA2 | Ca2+, фосфорилирование | эпителиальные клетки |
Строение и функции
правитьНАДФH-оксидаза — это мультикомпонентный ферментный комплекс. Типичный и наиболее исследованный представитель NOX2 состоит из двух мембранных субъединиц gp91phox (α-субъединица, продукт гена CYBA) и p22phox (β-субъединица), трёх цитозольных компонентов p40phox, p47phox, p67phox и низкомолекулярного G-белка Rac1 (моноциты) или Rac2 (гранулоциты) [1]. Распределение двух групп компонентов в субклеточных компартментах гарантирует неактивное состояние фермента в покоящейся клетке. Центральным компонентом НАДФH оксидазы является комплекс gp91phox и p22phox, или флавоцитохром b558 (по длине волны поглощения цитохрома), или флавоцитохром b-245, (по нормальному восстановительному потенциалу гемма −245 мВ при рН 7.0). Он расположен в плазматической мембране и в мембране специфических гранул, также может встраиваться в клеточную стенку вакуолей фагоцитов, где формирует канал для электронов, закачиваемых НАДФH-оксидазой из цитозоля в вакуоль.
Цитоплазматическая субъединица р47phox состоит из 390 аминокислотных остатков. С-концевой участок последовательности богат серином и аргинином. Аминокислотная последовательность р47phox также содержит два участка с SH3-доменами, один РХ домен и участок, богатый пролином. Субъединица р47phox связывается с цитохромом b558 во время активации. Эта субъединица отвечает за транспортировку цитозольного комплекса (р47 phox-р67phox-р40 phox) к мембране, во время активации оксидазы [2], что требует фосфорилирования р47phox.
Субъединица р67 phox состоит из 526 аминокислот и содержит два SH3 домена, четыре тетратрикопептидных участка и, как минимум, один участок, богатый пролином. р67 phox тесно связана с цитоскелетом и также фосфорилируется во время активации фагоцитов, но в меньшей степени, чем р47 phox. Субъединица р67phox взаимодействует с Rac1/2 и с цитохромом b558, и регулирует каталитическую активность комплекса.
Субъединица р40phox состоит из 339 аминокислот. Эта субъединица содержит один SH3 домен и один РХ домен. р40phox слабо фосфорилируется во время активации. Функциональная роль белка p40phox до конца не определена, в экспериментах in vitro было показано как его стимулирующее, так и ингибирующее действие на НАДФH оксидазу [3]. РХ-домен специфично связывается с фосфатидилинозит-3-фосфатом, который накапливается в фагосомальных мембранах, что способствует удержанию НАДФH оксидазного комплекса в мембране [4].
В сборке фермента также участвуют два малых ГТФ-связывающих белка: Rac2, локализованный в покоящейся клетке в цитоплазме в виде димерного комплекса с Rho-GDI, и Rap1A, локализованный в мембранах, из которых он может быть выделен вместе с цитохромом [5]. Обмен Rac-GDP на Rac-GTP является необходимым событием для инициации сборки и активации оксидазы [6]. Rac участвует в переносе электрона, и независимо от p67phox регулирует перенос электрона от НАДФH к ФАД [7]. При высоких концентрациях p67phox и Rac в бесклеточных системах для восстановления высокой активности НАДФH оксидазы не требуется p47phox [8].
Во время гемопоэза на стадии промиелоцита в клетках экспрессируются р40phox, p22phox, Rac2. На стадиях миелоцита и метамиелоцита клетки экспрессируют недостающие компоненты НАДФH-оксидазы и становятся способными продукцировать супероксидный радикал [9].
Кроме NOX2 в клетках обнаружены NOX1, NOX3, NOX4, NOX5, DUOX1 и DUOX2. Они отличаются своей регуляцией, функциями и экспрессией в различных клетках.
Ингибиторы
правитьДля ингибирования НАДФH-оксидаз используются два основных ингибитора флавин-содержащих ферментов:
См. также
правитьПримечания
править- ↑ [Babior, 1999; Babior, 2004; El-Banna et al., 2005; Geiszt, 2006]
- ↑ [Quinn et al., 1993; El-Benna et al., 1994]
- ↑ [Wientjes, 1995; El-Benna et al., 2005]
- ↑ [Groemping, Rittinger, 2005]
- ↑ [Werner, 2004; Wilkinson, Landreth, 2006]
- ↑ [Babior et al., 2002; Werner, 2004; Wilkinson, Landreth, 2006]
- ↑ [Diebold et al., 2001]
- ↑ [Freeman et al., 1996]
- ↑ [Hua et al., 2000]
Ссылки
править- van der Vliet A. NADPH oxidases in lung biology and pathology: host defense enzymes, and more (англ.) // Free Radic. Biol. Med.[англ.] : journal. — 2008. — March (vol. 44, no. 6). — P. 938—955. — doi:10.1016/j.freeradbiomed.2007.11.016. — PMID 18164271. — PMC 2323509.
- Незримое одеяние голых тварей. Ю. А. Лабас, А. В. Гордеева, Л. Г. Наглер (Природа. стр.3-10, № 12, 2006 г.)