Этил
Этил С2Н5 — одновалентный радикал этана (С2Н6)[1]. Следует отделять частицу — свободный радикал •СН2—CH3 (частица с неспаренным электроном на внешней орбитали) и группу атомов — этильная группа — СН2—CH3 (также обозначается как —Et), являющейся частью химического соединения.
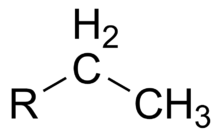
Этильный радикал
правитьВ промышленности производится расщеплением бутана. Время жизни — около нескольких микросекунд, но оно может быть увеличено при помощи ингибиторов. Химически крайне активен, легко димеризуется с образованием бутана
CH2CH3• + •CH2CH3 → CH2CH3CH2CH3
Образуется в свободном виде при некоторых реакциях:
- при распаде тетраэтилсвинца
- Pb(CH2CH3)4 →(t) Pb + 4CH3CH2•
- при распаде некоторых азосоединений (содержат группу —N=N—)
- при реакции хлорирования, нитрования, окисления этана
- Cl2 (hν или t°)→ 2Cl•
- Cl• + CH3CH3→ HCl + CH3CH2•
Легко реагирует с кислородом, галогенами и другими веществами.
Этильная группа
правитьЯвляется заместителем во множестве органических соединений. Введение этильной группы может осуществляется:
- по реакции SN2 замещения при использовании иодэтана, диэтилсульфата, этилтозилата.
- Et2NH + EtI → Et3N + HI
- при реакции соединений с электрофильными группами (С—Hal, С=O, —CN) с металлорганическими соединениями (EtMgCl, Zn(CH2CH3)2)
- Me2CO + EtMgCl → EtMe2C—O—MgCl
Введение в соединение этильной группы увеличивает липофильность вещества.
См. также
правитьПримечания
править- ↑ Кремлёв А. М., Менделеев Д. И. Этил, радикал // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература
править- Горбов А. И. Этил, гипотетический радикал // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Кремлёв А. М., Менделеев Д. И. Этил, радикал // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |