Цис-транс-изомерия[1][2] или геометрическая изомерия — один из видов стереоизомерии: заключается в возможности расположения заместителей по одну или по разные стороны плоскости двойной связи или неароматического цикла. Все геометрические изомеры относятся к диастереомерам, так как не являются зеркальными отражениями друг друга. Цис- и транс-изомеры встречаются как среди органических соединений, так и среди неорганических. Понятия цис и транс не используются в случае конформеров, двух геометрических форм, легко переходящих друг в друга, вместо них используются обозначения «син» и «анти».
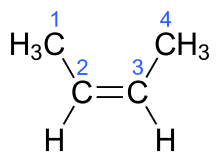
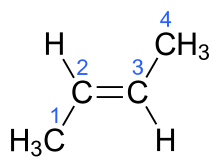
Обозначения «цис» и «транс» произошли из латыни, в переводе с этого языка цис означает «на одной стороне»[3], а транс — «на другой стороне» или «напротив». Термин «геометрическая изомерия» согласно ИЮПАК считается устаревшим синонимом цис-транс-изомерии[4].
Следует помнить, что цис-транс-номенклатура описывает относительное расположение заместителей, и не следует путать её с E,Z-номенклатурой, которая даёт абсолютное стереохимическое описание. E/Z-номенклатура позволяет указывать расположение заместителей относительно только двойной связи (не цикла), однако может применяться и при наличии нескольких двойных связей.
Органическая химия
правитьЕсли у диастереомера заместители расположены по одну сторону от двойной связи, такой изомер обозначают как цис-, если они расположены по разные стороны от плоскости двойной связи, то это транс-изомер. В качестве примера можно привести маленький углеводород 2-бутен.
Цис-транс-изомерией проявляют также и алициклические соединения, у которых заместители могут располагаться по одну или по разные стороны плоскости кольца. В качестве примера можно привести 1,2-дихлорциклогексан:
| транс-1,2-дихлорциклогексан | цис-1,2-дихлорциклогексан |
Различие в физических свойствах
правитьЦис- и транс-изомеры как правило отличаются по своим физическим свойствам. Эти различия проистекают из различия в форме молекулы, разного расстояния между заместителями и функциональными группами, а также из отличия общего дипольного момента.
Отличия могут быть незначительными, как в случае температуры кипения алкенов с прямой цепью, таких как 2-пентен, цис-изомер которого кипит при 37 °C, а транс-изомер — при 36 °C[5]. Разница между цис- и транс- становится ещё больше, если в молекуле есть поляризованные связи, как в 1,2-дихлорэтилене. Цис-изомер в данном случае кипит при 60,3 °C, а транс-изомер закипает при 47,5 °C[6]. В случае цис-изомера эффект от двух полярных связей C−Cl складываются, образуя сильный молекулярный диполь, что даёт начало сильным межмолекулярным взаимодействиям (силам Кеезома), которые добавляются к дисперсионным силам и приводит к увеличению точки кипения. В транс-изомере, напротив, подобного не происходит, поскольку два момента C−Cl связей расположены друг напротив друга и аннулируют друг друга, не создавая дополнительный дипольный момент (хотя их квадрупольный момент совсем не равен нулю).
Два геометрических изомера бутендиовой кислоты настолько сильно отличаются по своим свойствам и реакционной способности, что даже получили разные названия: цис-изомер называется малеиновая кислота, а транс-изомер — фумаровая кислота. Ключевое свойство, определяющее относительную температуру кипения, — полярность молекулы, так как она усиливает межмолекулярные взаимодействия, тем самым повышая температуру кипения. В такой же манере симметрия определяет температуру плавления, поскольку симметричные молекулы лучше упаковываются в твёрдом состоянии, даже если полярность молекулы не меняется. Один из примеров такой зависимости — олеиновая и элаидиновая кислоты; олеиновая кислота, цис-изомер, имеет температуру плавления в 13,4 °C, и при комнатной температуре становится жидкостью, в то время как транс-изомер, элаидиновая кислота, обладает более высокой температурой плавления в 43 °C, поскольку более прямой транс-изомер имеет более плотную упаковку и остаётся твёрдым при комнатной температуре.
Таким образом транс-изомеры, будучи менее полярными и более симметричными, обладают более низкими температурами кипения и более высокими температурами плавления, а цис-изомеры, которые в целом более полярны и менее симметричны, имеют более высокие температуры кипения и более низкие температуры плавления, лучше растворяются в воде или инертных растворителях, а также часто имеют более высокую теплоту сгорания, что связано с их меньшей стабильностью[7].
Цис-транс-изомеры дикарбоновых кислот различаются и по кислотности: малеиновая кислота (цис) является значительно более сильной кислотой, чем фумаровая (транс). Так, первая константа диссоциации для фумаровой кислоты pКa1 = 3,03, а для малеиновой кислоты pKa1 = 1,9. Наоборот, константа диссоциации второй карбоксильной группы для фумаровой кислоты больше, чем для малеиновой, а именно: для фумаровой кислоты pKa2 = 4,44, а для малеиновой кислоты pKa2 = 6,07. Благодаря пространственной близости карбоксильных групп в цис-форме увеличивается склонность водорода к ионизации, поэтому первая константа малеиновой кислоты оказывается больше. Однако второму протону труднее преодолеть притяжение двух сближенных карбоксильных групп в цис-изомере, поэтому вторая константа диссоциации малеиновой кислоты меньше, чем у фумаровой[8]. Аналогичный принцип действует и для алициклических дикарбоновых кислот, однако с увеличением размера кольца следует также учитывать влияние неплоской формы цикла[9].
Вицинальная константа ядерной спин-спиновой связи (3JHH), измеряемая при помощи ЯМР-спектроскопии, больше для транс-изомеров (диапазон: 12—18 Гц; в среднем: 15 Гц), чем для цис-изомеров (диапазон: 0—12 Гц; в среднем: 8 Гц)[10].
Стабильность
правитьКак правило для ациклических систем транс-изомер оказывается более стабильным, чем цис. Причина этого обычно заключается в усилении нежелательных стерических взаимодействиях близко расположенных заместителей в цис-изомере. По этой же причине удельная теплота сгорания транс-изомеров ниже чем у цис, что указывает на большую термодинамическую стабильность[7]. Исключением из этого правила являются 1,2-дифторэтилен, 1,2-дифтордиазен (FN=NF), 1-бромпропен-1 и несколько других галоген- и кислород-замещённых этиленов. В данном случае цис-изомер оказывается более стабильным, чем транс-изомер поскольку между такими заместителями преобладают не силы отталкивания, а силы притяжения (типа сил Лондона). К тому же благодаря относительно небольшому объёму заместителей не возникает стерических затруднений[11][12]. Из 1,2-дигалогенэтиленов только у 1,2-дийодэтилена транс-изомер стабильнее, чем цис-изомер, поскольку из-за большого радиуса атомы йода испытывают сильное пространственное взаимодействие, если находятся по одну сторону двойной связи[13].
Взаимопревращение изомеров
правитьГеометрические изомеры, различие которых связано с положением заместителей вокруг двойной связи, отличаются от стереоизомерных форм иного типа — конформеров. Раздельное существование цис- и транс-изомеров в сущности возможно лишь благодаря высокому энергетическому барьеру вращения вокруг двойной связи, что делает возможным раздельное существование цис- и транс-изомеров, в то время как конформеры существуют только в виде равновесной смеси. Величина барьера вращения вокруг двойной связи в простых алкенах составляет 250—270 кДж/моль. Однако, если поставить с одной стороны сильные доноры электронов (-SR), а с другой — группы, сильные акцепторы электронов (-CN, -COC6H5), поляризовав таким образом двойную связь, то это приведёт к существенному снижению барьера вращения. Барьер вращения вокруг поляризованной таким образом связи может быть снижен до 60—100 кДж/моль. Низкие энергетические барьеры, когда энергетическая разница между цис-транс-изомерами и конформерами сглаживается, обнаружены для аминопроизводных ацетоуксусного эфира и енаминокетонов. Показано, что в таких системах положение равновесия зависит от природы растворителя. Так, енаминокетоны в неполярных растворителях на 100 % существуют в цис-форме, стабилизированной внутренней водородной связью, а в полярных растворителей появляется до 50 % транс-формы[14].
E,Z-номенклатура
правитьСистема обозначений цис-транс хорошо применима только для именования изомерных алкенов с двумя разными видами заместителей при двойной связи, в сложных молекулах такая номенклатура становится слишком неопределённой. В этих случаях используют разработанную ИЮПАК E,Z-систему обозначений, которая однозначно определяет название соединений для всех возможных случаев, а потому особенно полезна для именования три- и тетразамещённых алкенов. Такая система позволяет избежать путаницы касательно того какие группы следует считать цис- или транс- по отношению к друг другу.
Если две старшие группы расположены по одну сторону двойной связи, то есть находятся в цис-положении друг к другу, то такое вещество называют Z-изомером (от нем. zusammen — вместе). Когда же старшие группы расположены по разные стороны двойной связи (в транс-ориентации), то такой изомер называют E-изомером (от нем. entgegen — напротив). Порядок старшинства групп и атомов определяется по правилам Кана — Ингольда — Прелога. Для каждого из двух атомов в двойной связи необходимо определить старшинство каждого заместителя. Если оба старших заместителя расположены по одну сторону от плоскости π-связи, то такую конфигурацию обозначают символом Z, если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом E[2].
Следует отметить, что цис/транс и E,Z-номенклатуры опираются на сравнение разных заместителей алкенов, поэтому Z-изомер не всегда соответствует цис-изомеру, а E-изомер — транс-изомеру. Например, транс-2-хлорбутен-2 (две метильных группы C1 и C4, на главной цепи бутена-2а находятся в транс-ориентации) является (Z)-2-хлорбутеном-2 (хлор старше, чем метил, который в свою очередь старше водорода, поэтому хлор и C4-метил рассматриваются как расположенные вместе).
В неорганической химии
правитьЦис–транс-изомерия встречается и в неорганических соединениях, в первую очередь в диазенах и комплексных соединениях.
Диазены
правитьДиазены (и схожие с ними дифосфены) проявляют цис-транс-изомерию. Как и в случае органических соединений, цис-изомер более реакционноспособен, только он способен восстанавливать алкены и алкины до алканов. Транс-изомер, сближаясь с алкеном, не может выстроить свои атомы водорода в линию для эффективного восстановления алкена, а цис-изомер благодаря соответствующей форме успешно справляется с этой задачей.
| транс-диазен | цис-диазен |
Комплексные соединения
правитьНеорганические координационные соединения с октаэдрической или плоской квадратной геометрией также подразделяются на цис-изомеры, в которых одинаковые лиганды расположены рядом, и транс-изомеры, в которых лиганды отстоят друг от друга.
Например, два геометрических изомера плоского квадратного строения существуют для Pt(NH3)2Cl2, феномен, который Альфред Вернер объяснил в 1893 году. Цис-изомер с полным названием цис-дихлородиамминплатина(II) обладает противоопухолевой активностью, что было продемонстрировано Барнеттом Розенбергом в 1969 году. Сейчас это вещество известно в химиотерапии под коротким названием цисплатин. Транс-изомер (трансплатин), напротив, не обладает какой-либо лекарственной активностью. Каждый из этих изомеров можно синтезировать, опираясь на транс-эффект, что позволяет получить преимущественно нужный изомер.
Для октаэдрических комплексов с формулой MX4Y2 тоже существуют два изомера. (Здесь M — атом металла, а X и Y — лиганды разных видов.) В цис-изомере два лиганда Y примыкают друг к другу под углом 90°, как и показано для атомов хлора в цис-[Co(NH3)4Cl2]+ на левой картинке. В транс-изомере, показанном справа, два атома хлора расположены на противоположных концах диагонали, проходящей через центральный атом кобальта.
Схожий тип изомерии октаэдральных комплексов состава MX3Y3 — это гран-ос-изомерия, или гранево-осевая изомерия, когда некоторое количество лигандов оказываются в цис- или транс-положении друг к другу. В гран-изомерах лиганды одного типа занимают вершины треугольной грани октаэдра, а в ос-изомерах эти же лиганды находятся в трёх соседних позициях так, что два лиганда оказываются по разные стороны от центрального атома и на одной оси с ним[15].
См. также
правитьПримечания
править- ↑ Стереоизомерия // Краткая химическая энциклопедия / Под ред. И. Л. Кнунянца. — 1964. — Т. 4.
- ↑ 1 2 Грандберг И. И. Органическая химия. — Нижний Новгород: Дрофа, 2001. — С. 178—179. — 672 с. — 10 000 экз. — ISBN 5710739545.
- ↑ Charlton T. Lewis, Charles Short, A Latin Dictionary (Clarendon Press, 1879) Архивная копия от 24 сентября 2015 на Wayback Machine Entry for cis
- ↑ IUPAC Gold Book internet edition: «geometric isomerism».
- ↑ Chemicalland values. Chemicalland21.com. Дата обращения: 22 июня 2010. Архивировано 21 апреля 2021 года.
- ↑ CRC Handbook of Chemistry and Physics (неопр.). — 60th. — С. C—298.
- ↑ 1 2 March, Jerry. Advanced Organic Chemistry, Reactions, Mechanisms and structure (англ.). — 3rd. — P. 111. — ISBN 0-471-85472-7.
- ↑ В. М. Потапов. Стереохимия. — Москва: Издательство «Химия», 1976. — С. 426. — 696 с.
- ↑ Э. Илиел. Стереохимия соединений углерода. — Москва: Мир, 1965. — С. 184.
- ↑ Dudley H. Williams, Ian. Table 3.27 // Spectroscopic Methods in Organic Chemistry (англ.). — 4th rev.. — McGraw-Hill Education, 1989.
- ↑ Bingham, Richard C. The stereochemical consequences of electron delocalization in extended π systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1976. — Vol. 98, no. 2. — P. 535—540. — doi:10.1021/ja00418a036.
- ↑ Craig, N. C.; Chen, A.; Suh, K. H.; Klee, S.; Mellau, G. C.; Winnewisser, B. P.; Winnewisser, M. Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1997. — Vol. 119, no. 20. — P. 4789. — doi:10.1021/ja963819e.
- ↑ В. М. Потапов. Стереохимия. — Москва: Издательство «Химия», 1976. — С. 429. — 696 с.
- ↑ В. М. Потапов. Стереохимия. — Москва: Издательство «Химия», 1976. — С. 428. — 696 с.
- ↑ Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность / Пер. с англ./Под ред. Б. Д. Степена, Р. А. Лидина. — Москва: Химия, 1987. — С. 337. — 696 с.