Топоизомеразы
Топоизомера́зы (англ. topoisomerase) — класс ферментов-изомераз, которые влияют на топологию ДНК[1]. Топоизомеразы способны релаксировать сверхспирализованные молекулы ДНК путём внесения одно- или двуцепочечных разрывов с последующим восстановлением (лигированием)[2]. Вместе с тем в некоторых случаях топоизомеразы могут вносить в ДНК отрицательные супервитки или катенаны[3].
Впервые топоизомеразы были описаны профессором Гарвардского университета Джеймсом Вонгом[4].
Топоизомеразы, облегчая расплетание цепей ДНК в двойной спирали, играют важную роль в процессах репликации и транскрипции. Показана роль топоизомераз в образовании петель хроматина во время конденсации хромосом[3]. Встраивание вирусной ДНК в хромосомы хозяина и другие формы рекомбинации также требуют присутствия топоизомераз[5].
Классификация
правитьВ зависимости от механизма действия топоизомеразы подразделяют на топоизомеразы I типа, вносящие одноцепочечные разрывы без затрат энергии, и топоизомеразы II типа, осуществляющие внесение двуцепочечных разрывов с затратой АТФ. Особое место среди топоизомераз занимает ДНК-гираза, характерная для кишечной палочки E. coli[2].
В следующей таблице перечислены основные особенности различных типов топоизомераз:
| Топоизомеразы | IA | IB | IIA | IIB |
|---|---|---|---|---|
| Необходимость ионов металлов | Да | Нет | Да | Да |
| Зависимость от АТФ | Нет | Нет | Да | Да |
| Разрыв | оц | оц | дц | дц |
| Конец прикрепления | 5' | 3' | 5' | 5' |
| Изменение числа супервитков | ±1 | ±1 | ±2 | ±2 |
Топоизомеразы I
правитьТопоизомеразы I[англ.] (КФ 5.99.1.2) представляют собой мономерные белки. Они релаксируют ДНК, внося одноцепочечные разрывы без затрат АТФ. Механизм этого таков. Внесение одноцепочечных разрывов происходит за счёт остатка аминокислоты тирозина, который осуществляет нуклеофильную атаку фосфатной группы ДНК, образуя фосфотирозин[6]. Сам фермент при этом связывается с высвободившимся 3'- или 5'-концом цепи. В зависимости от того, к какому концу присоединяется топоизомераза, выделяют:
- топоизомеразы IA-типа, связывающиеся с 5'-концом; снимают только отрицательную суперспирализацию;
- топоизомеразы IB-типа, связывающиеся с 3'-концом[7]; снимают как положительную, так и отрицательную суперспирализацию[2].
Такой механизм действия не требует затрат энергии, то есть при работе топоизомераз I типа АТФ не расходуется[6]. Число витков при этом изменяется на 1[3].
Первая топоизомераза I типа, как уже отмечалось, была выделена в клетках E. coli. В 1972 году топоизомеразы этого типа были обнаружены в клетках млекопитающего, впоследствии — в дрожжевых клетках. Топоизомеразы I типа известны у архей, например, IA-топоизомераза термофильной археи Desulfurococcus amylolyticus, а также у некоторых вирусов, например, вируса оспы[7].
Топоизомеразы II
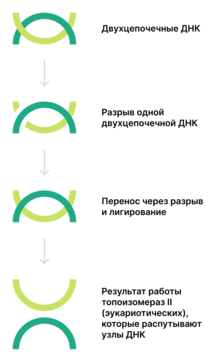
правитьТопоизомеразы II[англ.] (КФ 5.99.1.3) функционируют у прокариот в виде тетрамеров, у эукариот — в виде димеров. Они осуществляют АТФ-зависимое расщепление обеих цепей ДНК с последующим переносом цепей через разрыв и его лигированием. Разрыв происходит из-за связывания тирозинов топоизомеразы с ДНК с образованием двух 5'-фосфодиэфирных связей. В образовавшийся разрыв проходит другая двуцепочечная ДНК. Таким образом, число положительных или отрицательных супервитков изменяется на 2 (а не на 1, как у топоизомераз I). Итак, топоизомеразы II могут катенировать и декатенировать узлы ДНК. Относящаяся к этому типу ДНК-гираза вносит отрицательные супервитки[8].
Топоизомеразы II, как и топоизомеразы I, подразделяют на 2 группы: IIA и IIB. Однако анализ структур топоизомераз IА, IIА и IIB выявил их большое структурное сходство, в частности, наличие специального фолда для связывания с ионами металлов[9].
Разнообразие топоизомераз
правитьВ следующей таблице кратко характеризованы топоизомеразы из различных классов, выделенные из различных организмов[9].
| Топоизомераза | Тип | Организм | Размер (кДа) и строение субъединицы | Особенности |
|---|---|---|---|---|
| Бактериальная топоизомераза I (ω-белок) | IA | Бактерии (в т. ч. E. coli) | 97; мономер | Неспособна релаксировать положительные супервитки |
| Эукариотическая топоизомераза I | IB | Эукариоты (в т. ч. человек) | 91; мономер | Может релаксировать как положительные, так и отрицательные супервитки |
| Топоизомераза I вируса коровьей оспы | IB | Вирус коровьей оспы | 37; мономер | АТФ стимулирует активность фермента |
| Топоизомераза III | IA | Бактерии (в т. ч. E. coli) | 73; мономер | Имеет сильную декатенирующую активность |
| Обратная гираза | IA | Термофильные археи (в т. ч. Sulfolobus acidocaldarius | 143; мономер | Может АТФ-зависимо вносить положительные супервитки в ДНК |
| ДНК-гираза | IIA | Бактерии (в т. ч. E. coli), некоторые низшие эукариоты | 97 и 99 A2B2 | Может АТФ-зависимо вносить отрицательные супервитки в ДНК |
| Т4-топоизомераза | IIA | Фаг Т4 | 58, 51 и 18; 2 копии каждой субъединицы | Релаксирует ДНК, но не суперспирализует (АТФ-зависимо) |
| Эукариотическая топоизомераза II | IIA | Эукариоты (в т. ч. человек) | 174; гомодимер | Релаксирует ДНК, но не суперспирализует (АТФ-зависимо) |
| Топоизомераза IV | IIA | Бактерии (в т. ч. E. coli) | 84 и 70 C2E2 | Релаксирует ДНК, но не суперспирализует, сильная декатеназа (АТФ-зависимая) |
| Топоизомераза VI | IIB | Археи (в т. ч. Sulfolobus shibatae) | 45 и 60 A2B2 | Релаксирует ДНК, но не суперспирализует (АТФ-зависимо) |
Медицинское значение
правитьТопоизомеразы играют важную роль в процессах роста и деления клетки, в связи с чем они нередко являются мишенями различных лекарств[9] — ингибиторов топоизомераз[англ.].
Так, ДНК-гираза и близкая к ней топоизомераза IV являются мишенями двух основных групп антибактериальных препаратов: хинолонов и кумаринов. Хинолоны (в том числе налидиксовая кислота и ципрофлоксацин) предположительно блокируют стадию разрыва и лигирования в работе гиразы. Кумарины (в их числе новобиоцин[англ.] и кумермицин А1[англ.]) действуют совершенно иначе: они блокируют гидролиз АТФ гиразой[9].
Эукариотические топоизомеразы также являются мишенями многих лекарственных препаратов, в частности, противоопухолевых. Например, противораковый препарат камптотецин[англ.], производные которого широко используются в противораковой химиотерапии, действует на человеческую топоизомеразу I подобно тому, как хинолоны действуют на гиразу[9].
Кроме того, что топоизомеразы могут быть мишенями антибиотиков и противоопухолевых препаратов, они также могут выступать как мишени токсинов. Так, бактериальный токсин Ссdb действует на гиразу. Ссdb представляет собой небольшой белок массой 11,7 кДа. Он входит в состав токсин-антитоксиновой системы, образуя комплекс с другим белком — Ссda, и играет роль в стабилизации F-плазмиды E. coli. Утрата F-плазмиды ведёт к утрате относительно нестабильного Ссdа. В результате Ссdb высвобождается, блокирует гиразу и тем самым убивает хозяйскую клетку. Изучение механизма действия таких токсинов может дать новые идеи для разработки новых ингибиторов гиразы[9].
В следующей таблице приведена информация по различным ингибиторам топоизомераз[9]:
| Ингибитор | Топоизомераза-мишень | Терапевтическое действие |
|---|---|---|
| Хинолоны (в т. ч. ципрофлоксацин) | ДНК-гираза и топоизомераза IV | Эффективные антибактериальные средства |
| Кумарины (в т. ч. новобиоцин[англ.]) | ДНК-гираза и топоизомераза IV | Антибиотики, но не используются широко |
| Камптотецины[англ.] (в т. ч. топотекан) | Человеческая топоизомераза I | Противораковые препараты |
| Амсакрин[англ.] (mAMSA) | Человеческая топоизомераза II | Противораковые препараты |
| Подофиллотоксины (в т. ч. тенипозид) | Человеческая топоизомераза II | Противораковые препараты |
Примечания
править- ↑ Champoux J.J. DNA topoisomerases: structure, function, and mechanism (англ.) // Annu. Rev. Biochem.[англ.] : journal. — 2001. — Vol. 70. — P. 369—413. — doi:10.1146/annurev.biochem.70.1.369. — PMID 11395412.
- ↑ 1 2 3 Коничев, Севастьянова, 2012, с. 99.
- ↑ 1 2 3 Коничев, Севастьянова, 2012, с. 100.
- ↑ National Academy of Sciences: NAS Award in Molecular Biology. National Academy of Science. Дата обращения: 7 января 2009. Архивировано из оригинала 29 декабря 2010 года.
- ↑ Жимулев И. Ф. Общая и молекулярная генетика. — 1. — Новосибирск: Издательство Новосибирского университета, 2002. — 459 с. — 2000 экз. — ISBN 5761505096.
- ↑ 1 2 Арефьев В. А., Лисовенко Л. А. ДНК-релаксирующие ферменты // Англо-русский толковый словарь генетических терминов. — М.: Изд-во ВНИРО, 1995. — ISBN 5-85382-132-6.
- ↑ 1 2 Д. В. Бугреев, Г. А. Невинский. Структура и механизм действия топоизомераз IА-типа // Успехи биологической химии. — 2009. — Т. 49. — С. 129—158. Архивировано 21 марта 2014 года.
- ↑ Коничев, Севастьянова, 2012, с. 99—100.
- ↑ 1 2 3 4 5 6 7 DNA topoisomerases. Дата обращения: 19 марта 2014. Архивировано 19 марта 2014 года.
См. также
правитьЛитература
править- James C. Wang (2009) Untangling the Double Helix. DNA Entanglement and the Action of the DNA Topoisomerases, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2009. 245 pp. ISBN 9780879698799
- Коничев А. С., Севастьянова Г. А. Молекулярная биология. — Издательский центр «Академия», 2012. — 400 с. — ISBN 978-5-7695-9147-1.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |