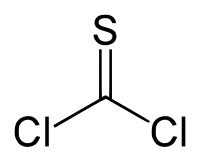
Тиофосге́н — оранжево-красная жидкость с резким запахом, дихлорангидрид монотиоугольной кислоты, сернистый аналог фосгена. Растворим в диэтиловом эфире, и других органических растворителях, гидролизуется водой, реагирует со спиртами. В больших концентрациях токсичен.
| Тиофосген | |
|---|---|
 | |
| Общие | |
| Традиционные названия | Тиофосген, тиокарбонилхлорид |
| Хим. формула | CSCl2 |
| Рац. формула | CCl2S |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 114,98 г/моль |
| Плотность | 1,508 г/см³ |
| Термические свойства | |
| Температура | |
| • кипения | 73 °C |
| • вспышки | 62 °C |
| Оптические свойства | |
| Показатель преломления | 1.548 |
| Классификация | |
| Рег. номер CAS | 463-71-8 |
| PubChem | 10040 |
| Рег. номер EINECS | 207-341-6 |
| SMILES | |
| InChI | |
| RTECS | XN2450000 |
| ChEBI | 29366 |
| ChemSpider | 9645 |
| Безопасность | |
| ЛД50 | 15-20 мг/кг |
| Токсичность |
весьма ядовит, ПДК = 0,5 мг/м³ |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Синтез
правитьТиофосген может быть получен при взаимодействии четыреххлористого углерода с серой или сероводородом при высоких температурах:
- ,
однако эти методы не имеют препаративного значения.
И в лабораторной практике, и в промышленности тиофосген обычно синтезируют хлорированием сероуглерода с последующим восстановлением образующегося при хлорировании трихлорметилсульфенилхлорида (перхлорметилмеркаптана):
При восстановлении трихлорметилсульфенилхлорида используются различные восстановители, так, например, в лабораторной практике используется олово в соляной кислоте[1]. В промышленности непрерывное хлорирование сероуглерода ведут в присутствии воды, что обеспечивает удаление образующегося в процессе монохлорида серы за счет гидролиза и в качестве восстановителя используется сероводород или диоксид серы[2].
Биологические свойства
правитьОчень токсичен.
Реакционная способность и применение
правитьТиофосген является сильным электрофильным реагентом, однако менее активен, чем его кислородный аналог фосген.
Тиофосген медленно гидролизуется водой с образованием диоксида углерода, сероводорода и хлороводорода:
Со спиртами и фенолами тиофосген образует реакционноспособные хлортиоформиаты:
которые реагируют со спиртами, аминами и тиолами с образованием тиокарбонатов, дитиокарбонатов и тиокарбаматов соответственно:
С первичными и вторичными аминами тиофосген реагирует подобно фосгену: с одним эквивалентом амина он образует тиокарбамоилхлориды, которые при нагревании отщепляют хлороводород с образованием изотиоцианатов:
И тиокарбамоилхлориды, и изотиоцианаты при реакции с избытком амина образуют тиомочевины, эти реакции используются как препаративные методы синтеза изотиоцианатов[3] и тиомочевин:
При взаимодействии тиофосгена с кетиминами образуются α-хлоризотиоцианаты:
Такие хлоризотиоцианаты стабильны только в случае отсутствия α-водородных атомов в заместителях, при наличии α-водородов от них отщепляется хлороводород, что ведет к образованию алкенилизотиоцианатов:
Тиофосген также ацилирует арилдиазокетоны с образованием α-хлортиоацилхлоридов:
При окислении надбензойной кислотой тиофосген окисляется до S-оксида:
Тиофосген подвергается фотохимической димеризации с образованием 2,2,4,4-тетрахло-1,3-дитиетана.
Литература
править- Katritzky, Alan R.; Otto Meth-Cohn, Thomas L. Gilchrist, Charles Wayne Rees. Comprehensive Organic Functional Group Transformations: Synthesis: carbon with three or four attached heteroatoms (англ.). — Elsevier, 1995. — ISBN 9780080427041.
- Sharma, Satyavan. Thiophosgene in Organic Synthesis (неопр.) // Synthesis. — 1978. — Т. 1978, № 11. — С. 803—820. — ISSN 1437-210X 0039-7881, 1437-210X. — doi:10.1055/s-1978-24896. Архивировано 2 июня 2018 года.
Примечания
править- ↑ G. Malcolm Dyson. Thiophosgene. Organic Syntheses, Vol. 6, p. 86 (1926); Coll. Vol. 1, p.506 (1941). Дата обращения: 3 января 2012. Архивировано 6 июля 2011 года.
- ↑ Grayson, J. Ian. Industrial Scale Synthesis of Thiophosgene and Its Derivatives (англ.) // Org. Process Res. Dev.[англ.] : journal. — 1997. — Vol. 1, no. 3. — P. 240—246. — ISSN 1083-6160. — doi:10.1021/op970002c.
- ↑ G. Malcolm Dyson. p-Chlorophenyl isothiocyanate. Organic Syntheses, Coll. Vol. 1, p.165 (1941); Vol. 6, p.18 (1926). Дата обращения: 3 января 2012. Архивировано из оригинала 22 октября 2012 года.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |