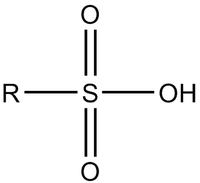
Сульфокислоты (сульфоновые кислоты) — органические соединения общей формулы RSO3H или R-SO2OH, где R — органический радикал. Сульфокислоты рассматриваются как органические соединения, замещенные по углероду сульфогруппой -SO3H [1].
Номенклатура
правитьНазвание сульфокислот образуется из названия соответствующего углеводорода и окончания «сульфокислота», например, CH3SO3H — метансульфокислота, C6H5SO3H — бензолсульфокислота. При наличии в веществе другой, более приоритетной функциональной группы, к названию основного вещества прибавляется префикс «сульфо», например, п-сульфобензойная кислота.
Свойства
правитьСульфогруппа -SO3H имеет тетраэдрическую конфигурацию, длины связей кислород-сера сульфонат-анионов RSO3- одинаковы и составляют 0,142 нм, углы O—S—O ~108-110°. В ИК-спектрах сульфокислот присутствуют характеристические полосы асимметрических и симметрических колебаний при 1340—1350 и 1150—1160 см−1 соответственно, в спектрах ЯМР химический сдвиг протона сульфогруппы составляет 11-12 м.д.
Низшие сульфокислоты — обычно кристаллические гигроскопичные вещества, хорошо растворимые в воде. Являются сильными кислотами, как и их соли. Самой сильной сульфокислотой является трифторметансульфокислота CF3SO3H.
Сульфокислоты обладают всеми свойствами, присущими кислотам:
- способны реагировать с основаниями, образуя соли, например, бензолсульфонат натрия C6H5SO3Na
- со спиртами образуют сложные эфиры, например, этилбензолсульфонат C6H5SO2OC2H5
- образуют ангидриды и галогенангидриды, например, бензолсульфонилхлорид C6H5SO2Cl
- образуют амиды, например, бензолсульфониламид C6H5SO2NH2
Восстановление сульфокислот цинковой пылью приводит к сульфиновым кислотам RSO2H, действие более сильных восстановителей приводит к тиолам RSH.
Ароматические сульфокислоты способны вступать в реакции обмена сульфогруппы на другие функциональные группы:
Десульфирование ароматических сульфокислот является реакцией обратной сульфированию и также катализируется кислотами:
Обычно её проводят, пропуская в сульфокислоту или в её смесь с минеральной кислотой перегретый водяной пар при температуре 100÷250 °C. Гидроксильные и алкильные заместители в орто- и пара-положениях облегчают реакцию, галогены в тех же положениях затрудняют. Заместители в мета-положении оказывают меньшее влияние.[2]
В реакциях электрофильного замещения в ароматических соединениях (например, реакция Фриделя — Крафтса) сульфогруппа является электроноакцепторной группой и направляет замещение в мета-положение.
Получение
правитьАроматические сульфокислоты получают сульфированием ароматических углеводородов и их производных:
Алифатические сульфокислоты синтезируют:
- реакцией нуклеофильного обмена атома галогена галогеналканов на сульфогруппу SO3H
- сульфохлорированием алканов по свободно-радикальному механизму:
- Сульфоокислением алканов:
- окислением тиолов и органических дисульфидов сильными окислителями:
Применение
правитьСульфокислоты применяют как полупродукты в синтезе красителей, лекарственных веществ, поверхностно-активных веществ и др. Природными сульфокислотами являются таурин и цистеиновая кислота.
Примечания
править- ↑ sulfonic acids // IUPAC Gold Book. Дата обращения: 6 июля 2011. Архивировано 12 августа 2011 года.
- ↑ Сигэру Оаэ. Химия органических соединений серы. М., «Химия», 1975, с.458
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
- Курбатов В. Я., Менделеев Д. И., Хардин Д. А. Сульфоновые кислоты // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.