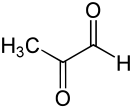
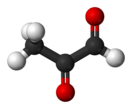
Метилглиоксаль
Метилглиоксаль (пирувальдегид, 2-оксопропаналь) — альдегид пировиноградной кислоты, является одновременно альдегидом и кетоном.
| Метилглиоксаль | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
2-оксопропаналь | ||
| Хим. формула | C3H4O2 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 72.0627 г/моль | ||
| Плотность | 1,0455 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • кипения | 72 °C | ||
| Классификация | |||
| Рег. номер CAS | 78-98-8 | ||
| PubChem | 880 | ||
| Рег. номер EINECS | 201-164-8 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 17158 | ||
| ChemSpider | 857 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Биология
правитьВ живых организмах метилглиоксаль образуется как побочный продукт нескольких метаболических путей. [1] Он может образоваться из 3-аминоацетона, промежуточного продукта катаболизма треонина либо в процессе перекисного окисления липидов. Однако, важнейший источник метилглиоксаля — гликолиз, где он получается в процессе неферментативного гидролиза фосфатной группы от глицеральдегид-фосфата и дигидроацетон-фосфата, двух промежуточных компонентов гликолиза. Метилглиоксаль является цитотоксическим продуктом, поэтому в клетке существует несколько механизмов инактивации, в том числе глиоксалазная система. Метилглиоксаль реагирует в клетке с глутатионом, образуя гемитиоацеталь, который превращается в S-D-лактоилглутатион под действием глиоксалазы I [2] и далее метаболизируется в D-лактат под действием глиоксалазы II. [3]
Патология
правитьВ силу своей реактивности метилглиоксаль играет большую роль в образовании поздних продуктов гликирования в процессе реакции Майяра. Более того, он считается важнейшим из гликирующих реагентов (т. е. ковалентно связывающихся с амино-группами белков, таких как глюкоза, галактоза и др.), приводящих к нарушению функций белков при диабете. [4].
См. также
правитьСсылки
править- ↑ Inoue Y., Kimura A. Methylglyoxal and regulation of its metabolism in microorganisms (англ.) // Advances in Microbial Physiology[англ.] : journal. — Academic Press, 1995. — Vol. 37. — P. 177—227. — PMID 8540421.
- ↑ Thornalley P. J. Glyoxalase I--structure, function and a critical role in the enzymatic defence against glycation (англ.) // Biochem. Soc. Trans.[англ.] : journal. — 2003. — Vol. 31, no. Pt 6. — P. 1343—1348. — doi:10.1016/S0006-2952(99)00132-X. — PMID 14641060. Архивировано 3 июля 2020 года.
- ↑ Vander Jagt D. L. Glyoxalase II: molecular characteristics, kinetics and mechanism (англ.) // Biochem. Soc. Trans.[англ.] : journal. — 1993. — Vol. 21, no. 2. — P. 522—527. — PMID 8359524.
- ↑ Shinohara M. Overexpression of glyoxalase-I in bovine endothelial cells inhibits intracellular advanced glycation endproduct formation and prevents hyperglycemia-induced increases in macromolecular endocytosis. (англ.) // J Clin Invest. : journal. — 1998. — Vol. 101, no. 5. — P. 1142—1147. — doi:10.1172/JCI119885. — PMID 9486985.