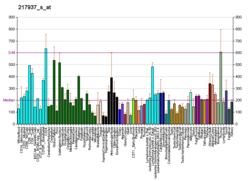
Гистондеацетилаза 7
Гистондеацетилаза 7 (англ. Histone deacetylase 7) — фермент, кодируемый у человека геном HDAC7 [5][6][7].
Функция
правитьГистоны играют важнейшую роль в регуляции транскрипции, клеточного цикла и процессов развития. Ацетилирование/деацетилирование гистонов изменяет структуру хромосом и влияет на доступ факторов транскрипции к ДНК. Белок, кодируемый этим геном имеет гомологию последовательности с членами семейства гистондезацетилазы. Этот ген ортологичен с геном HDAC7 мыши, белок которого стимулирует репрессию опосредования корепрессора транскрипции SMRT. Несколько альтернативных вариантов сплайсинга, кодирующих несколько изоформ были найдены для этого гена[7].
Взаимодействия
правитьHDAC7A, как было выявлено, взаимодействует с:
См также
правитьПримечания
править- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000061273 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000022475 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Marks P. A., Richon V. M., Rifkind R. A. Histone deacetylase inhibitors: inducers of differentiation or apoptosis of transformed cells (англ.) // Journal of the National Cancer Institute[англ.] : journal. — 2000. — August (vol. 92, no. 15). — P. 1210—1216. — doi:10.1093/jnci/92.15.1210. — PMID 10922406.
- ↑ Kao H. Y., Downes M., Ordentlich P., Evans R. M. Isolation of a novel histone deacetylase reveals that class I and class II deacetylases promote SMRT-mediated repression (англ.) // Genes & Development : journal. — 2000. — January (vol. 14, no. 1). — P. 55—66. — doi:10.1101/gad.14.1.55. — PMID 10640276. — PMC 316336.
- ↑ 1 2 Entrez Gene: HDAC7A histone deacetylase 7A.
- ↑ Lemercier C., Brocard M. P., Puvion-Dutilleul F., Kao H. Y., Albagli O., Khochbin S. Class II histone deacetylases are directly recruited by BCL6 transcriptional repressor (англ.) // The Journal of Biological Chemistry : journal. — 2002. — June (vol. 277, no. 24). — P. 22045—22052. — doi:10.1074/jbc.M201736200. — PMID 11929873.
- ↑ Lee H. J., Chun M., Kandror K. V. Tip60 and HDAC7 interact with the endothelin receptor a and may be involved in downstream signaling (англ.) // The Journal of Biological Chemistry : journal. — 2001. — May (vol. 276, no. 20). — P. 16597—16600. — doi:10.1074/jbc.C000909200. — PMID 11262386.
- ↑ 1 2 Fischle W., Dequiedt F., Fillion M., Hendzel M. J., Voelter W., Verdin E. Human HDAC7 histone deacetylase activity is associated with HDAC3 in vivo (англ.) // The Journal of Biological Chemistry : journal. — 2001. — September (vol. 276, no. 38). — P. 35826—35835. — doi:10.1074/jbc.M104935200. — PMID 11466315.
- ↑ Xiao H., Chung J., Kao H. Y., Yang Y. C. Tip60 is a co-repressor for STAT3 (англ.) // The Journal of Biological Chemistry : journal. — 2003. — March (vol. 278, no. 13). — P. 11197—11204. — doi:10.1074/jbc.M210816200. — PMID 12551922.
- ↑ Koipally J., Georgopoulos K. A molecular dissection of the repression circuitry of Ikaros (англ.) // The Journal of Biological Chemistry : journal. — 2002. — August (vol. 277, no. 31). — P. 27697—27705. — doi:10.1074/jbc.M201694200. — PMID 12015313.
Литература
править- Verdin E., Dequiedt F., Kasler H. G. Class II histone deacetylases: versatile regulators (англ.) // Trends in Genetics[англ.] : journal. — Cell Press, 2003. — May (vol. 19, no. 5). — P. 286—293. — doi:10.1016/S0168-9525(03)00073-8. — PMID 12711221.
- Maruyama K., Sugano S. Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides (англ.) // Gene[англ.] : journal. — Elsevier, 1994. — January (vol. 138, no. 1—2). — P. 171—174. — doi:10.1016/0378-1119(94)90802-8. — PMID 8125298.
- Suzuki Y., Yoshitomo-Nakagawa K., Maruyama K., Suyama A., Sugano S. Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library (англ.) // Gene[англ.] : journal. — Elsevier, 1997. — October (vol. 200, no. 1—2). — P. 149—156. — doi:10.1016/S0378-1119(97)00411-3. — PMID 9373149.
- Lee H. J., Chun M., Kandror K. V. Tip60 and HDAC7 interact with the endothelin receptor a and may be involved in downstream signaling (англ.) // The Journal of Biological Chemistry : journal. — 2001. — May (vol. 276, no. 20). — P. 16597—16600. — doi:10.1074/jbc.C000909200. — PMID 11262386.
- Fischle W., Dequiedt F., Fillion M., Hendzel M. J., Voelter W., Verdin E. Human HDAC7 histone deacetylase activity is associated with HDAC3 in vivo (англ.) // The Journal of Biological Chemistry : journal. — 2001. — September (vol. 276, no. 38). — P. 35826—35835. — doi:10.1074/jbc.M104935200. — PMID 11466315.
- Lemercier C., Brocard M. P., Puvion-Dutilleul F., Kao H. Y., Albagli O., Khochbin S. Class II histone deacetylases are directly recruited by BCL6 transcriptional repressor (англ.) // The Journal of Biological Chemistry : journal. — 2002. — June (vol. 277, no. 24). — P. 22045—22052. — doi:10.1074/jbc.M201736200. — PMID 11929873.
- Bryant H., Farrell P. J. Signal Transduction and Transcription Factor Modification during Reactivation of Epstein-Barr Virus from Latency (англ.) // Journal of Virology[англ.] : journal. — 2002. — October (vol. 76, no. 20). — P. 10290—10298. — doi:10.1128/JVI.76.20.10290-10298.2002. — PMID 12239305. — PMC 136559.
- Xiao H., Chung J., Kao H. Y., Yang Y. C. Tip60 is a co-repressor for STAT3 (англ.) // The Journal of Biological Chemistry : journal. — 2003. — March (vol. 278, no. 13). — P. 11197—11204. — doi:10.1074/jbc.M210816200. — PMID 12551922.
- Dequiedt F., Kasler H., Fischle W., Kiermer V., Weinstein M., Herndier B. G., Verdin E. HDAC7, a thymus-specific class II histone deacetylase, regulates Nur77 transcription and TCR-mediated apoptosis (англ.) // Immunity : journal. — Cell Press, 2003. — May (vol. 18, no. 5). — P. 687—698. — doi:10.1016/S1074-7613(03)00109-2. — PMID 12753745.
- Lee C. H., Chawla A., Urbiztondo N., Liao D., Boisvert W. A., Evans R. M., Curtiss L. K. Transcriptional repression of atherogenic inflammation: modulation by PPARdelta (англ.) // Science : journal. — 2003. — October (vol. 302, no. 5644). — P. 453—457. — doi:10.1126/science.1087344. — PMID 12970571.
- Li X., Song S., Liu Y., Ko S. H., Kao H. Y. Phosphorylation of the histone deacetylase 7 modulates its stability and association with 14-3-3 proteins (англ.) // The Journal of Biological Chemistry : journal. — 2004. — August (vol. 279, no. 33). — P. 34201—34208. — doi:10.1074/jbc.M405179200. — PMID 15166223.
- Kato H., Tamamizu-Kato S., Shibasaki F. Histone deacetylase 7 associates with hypoxia-inducible factor 1alpha and increases transcriptional activity (англ.) // The Journal of Biological Chemistry : journal. — 2004. — October (vol. 279, no. 40). — P. 41966—41974. — doi:10.1074/jbc.M406320200. — PMID 15280364.
- Beausoleil S. A., Jedrychowski M., Schwartz D., Elias J. E., Villén J., Li J., Cohn M. A., Cantley L. C., Gygi S. P. Large-scale characterization of HeLa cell nuclear phosphoproteins (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. — August (vol. 101, no. 33). — P. 12130—12135. — doi:10.1073/pnas.0404720101. — PMID 15302935. — PMC 514446.
- Jin J., Smith F. D., Stark C., Wells C. D., Fawcett J. P., Kulkarni S., Metalnikov P., O'Donnell P., Taylor P., Taylor L., Zougman A., Woodgett J. R., Langeberg L. K., Scott J. D., Pawson T. Proteomic, functional, and domain-based analysis of in vivo 14-3-3 binding proteins involved in cytoskeletal regulation and cellular organization (англ.) // Current Biology : journal. — Cell Press, 2004. — August (vol. 14, no. 16). — P. 1436—1450. — doi:10.1016/j.cub.2004.07.051. — PMID 15324660.