Бурая жировая ткань
Бу́рая жирова́я ткань — один из двух видов жировой ткани у млекопитающих. Бурый жир хорошо развит у новорождённых и у животных, впадающих в спячку[1]. У взрослого человека бурая жировая ткань присутствует и метаболически активна[2][3], однако она регрессирует с возрастом[4]. Основной функцией ткани является несократительный термогенез. В отличие от белых адипоцитов (клеток белой жировой ткани), имеющих одну крупную жировую каплю, в адипоцитах бурой ткани имеется несколько небольших жировых капель и множество митохондрий, содержащих железо (в цитохромах) и обусловливающих бурый цвет ткани[5].
| Бурая жировая ткань | |
|---|---|
| лат. textus adiposus fuscus | |
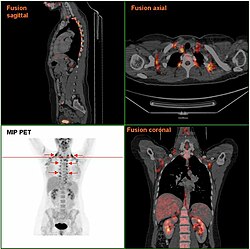 На снимке PET/CT показана бурая жировая ткань женщины | |
| Каталоги | |
Строение
правитьБурая жировая ткань выражена у новорождённых детей и некоторых животных (грызунов и животных, впадающих в спячку). Адипоциты бурой жировой ткани, по сравнению с клетками белой жировой ткани, имеют больше митохондрий и вместо одной крупной жировой капли содержат множество мелких жировых включений в цитоплазме (такие адипоциты называют мультилокулярными[6]). Бурый цвет обеспечивается железосодержащими пигментами цитохромами, расположенными в митохондриях. При голодании изменения бурой жировой ткани по сравнению с изменениями белой жировой ткани выражены меньше[7].
Термином «бежевый жир» называют белую жировую ткань, которая приобретает некоторые черты бурой жировой ткани, например, в её адипоцитах вместо одной крупной жировой ткани имеется несколько включений меньшего размера, увеличивается количество митохондрий и повышается уровень экспрессии гена UCP1, кодирующего белок термогенин[8].
Анатомия
правитьБурая жировая ткань, выраженная у новорождённых детей и некоторых животных (грызунов и млекопитающих, впадающих в спячку), располагается на шее, около лопаток, за грудиной, вдоль позвоночника, под кожей, между мышцами[7], в надключичной ямке[англ.], вокруг сердца, аорты, поджелудочной железы, надпочечников и трахеи[9]. Долгое время было принято считать, что у взрослого человека бурый жир отсутствует. Наличие у взрослого человека бурой жировой ткани было подтверждено в 2003 году в ходе позитронно-эмиссионной томографии, целью которой было обнаружение метастазов[10][11]. У взрослого человека бурый жир локализован в надключичной ямке, вдоль позвоночника, аорты, надпочечников, в средостении[12][2]. Остаётся пока неясным, являются ли эти отложения собственно бурым жиром или относятся к бежевому жиру — белым адипоцитам, приобретшим некоторые черты бурых адипоцитов[13][14].
Физиология
правитьОсновная функция бурой жировой ткани — термогенез. У животных в конце спячки и новорождённых детей в бурую жировую ткань поступает норадреналин, который, как и в белой жировой ткани, стимулирует гормоночувствительную липазу и запускает гидролиз триглицеридов. Однако, в отличие от белых адипоцитов, в бурых адипоцитах свободные жирные кислоты не высвобождаются в кровь, а быстро метаболизируются, что сопровождается повышением потребления кислорода и продуцированием тепла. Локальное повышение температуры в бурой жировой ткани приводит к нагреванию омывающей её крови, которая передаёт тепло на весь организм. Усиленная продукция тепла в бурых адипоцитах возможна благодаря тому, что в их внутренних митохондриальных мембранах в большом количестве содержится трансмембранный разобщающий белок термогенин, или UCP1. В присутствии свободных жирных кислот термогенин позволяет протонам поступать из межмембранного пространства непосредственно в матрикс митохондрии без прохождения протонов через АТФ-синтазу. Вместо образования АТФ энергия протонов идёт на выделение тепла[15]. Считается, что термогенин является симпортером протонов и свободных жирных кислот, но конкретный механизм его действия неясен[16]. Известно, что термогенин ингибируют АТФ, АДФ и ГТФ[17]. Термогенез в бурых адипоцитах также может активироваться при переедании[18].
У взрослого человека отложения бурого жира становятся более метаболически активными, однако этот эффект смягчается при приёме бета-адреноблокаторов. Показано, что бурая жировая ткань улучшает метаболизм глюкозы[19] и повышает чувствительность к инсулину[20], участвует в поддержании плотности[англ.] костной ткани. Под действием холода в скелетных мышцах и бурой жировой ткани повышается уровень фосфорилирования SIRT1, что приводит к деацетилированию PPARGC1A[англ.] и ряда других белков, в результате чего усиливается термогенез и повышается чувствительность к инсулину[21].
При адаптации к низким температурам белые адипоциты частично обратимо превращаются в бурые, приобретают большое количество мелких липидных капель вместо одной крупной, их профиль экспрессии генов становится близок к таковому у бурых адипоцитов (в частности, возрастает экспрессия гена UCP1, кодирующего термогенин), и так называемые бежевые адипоциты приступают к термогенезу[22]. При возвращении к нормальным условиям часть бежевых адипоцитов вновь становятся белыми. У мышей «побурение» белой жировой ткани полностью нивелируется за 21 день после окончания пребывания на холоде, а снижение экспрессии UCP1, кодирующего термогенин, наступает уже через 24 часа[23]. При повторном попадании на холод в бежевые адипоциты превращаются каждый раз одни и те же белые адипоциты[24]. Превращение белого адипоцита в бежевый контролируется несколькими транскрипционными факторами[25]: PPARγ, PRDM16[англ.][26], PGC-1α[англ.] и EBF2[27][28][29]. «Побурение» белого жира также стимулируют иризин, секретируемый мышечной тканью в ответ на физическую нагрузку[30], и FGF21[англ.], выделяемый печенью[8]. У мышей «побурение» стимулируют метионин-энкефалиновые пептиды, продуцируемые лимфоидными клетками врождённого иммунитета второго типа в ответ на действие интерлейкина 33 (IL-33)[31].
Развитие
правитьБурые адипоциты развиваются от мезенхимальных стволовых клеток[англ.], но в других локациях тела эмбриона, отличных от тех, где происходит дифференцировка белых адипоцитов (в параксиальной мезенхиме). Бурые адипоциты в ходе эмбрионального развития возникают раньше белых. У человека объём бурой жировой ткани относительно массы тела максимален при рождении, когда наиболее высока потребность в термогенезе, и в детстве почти полностью исчезает через инволюцию и апоптоз адипоцитов. У взрослых бурый жир наиболее активен у людей худощавого телосложения. При адаптации к холоду бежевые адипоциты могут превращаться в бурые, кроме того, возможна пролиферация и дифференцировка бурых адипоцитов от мезенхимальных клеток-предшественников. Автономные нервы не только стимулируют термогенную активность бурых адипоцитов, но также способствуют их дифференцировке и предотвращают апоптоз зрелых бурых адипоцитов[32].
Клиническое значение
правитьДоброкачественные опухоли, образованные бурыми адипоцитами, иногда называют гиберномами[англ.][33]. Гибернома представляет собой хорошо очерченную инкапсулированную клеточную массу от жёлтого до бурого цвета со средним размером 10 см. Гиберномы безболезненны и, как правило, залегают в подкожной ткани[34].
Под ожирением понимают состояние, при котором в организме накапливается избыток жировой ткани[35]. Конвертацию белой жировой ткани в бурую рассматривают как перспективную стратегию терапии ожирения[36].
История изучения
правитьЖировая ткань (точнее, бурая жировая ткань) впервые была описана в 1551 году швейцарским медиком и учёным-энциклопедистом Конрадом Геснером (1516—1565)[37].
В 1902 году было отмечено сходство между шейными жировыми отложениями у новорождённых младенцев и млекопитающих, впадающих в спячку. Активное исследование бурой жировой ткани возобновилось в 1960-х годах (в 1964 году Уильям Сильверман и его коллеги доказали, что у человека бурый жир также отвечает за термогенез), и к 1980-м годам установилось мнение, что у взрослых людей бурой жировой ткани нет. Это представление было пересмотрено в конце 2000-х годов[38].
Примечания
править- ↑ Gesta S., Tseng Y. H., Kahn C. R. Developmental origin of fat: tracking obesity to its source. (англ.) // Cell. — 2007. — 19 October (vol. 131, no. 2). — P. 242—256. — doi:10.1016/j.cell.2007.10.004. — PMID 17956727.
- ↑ 1 2 Nedergaard J., Bengtsson T., Cannon B. Unexpected evidence for active brown adipose tissue in adult humans. (англ.) // American Journal Of Physiology. Endocrinology And Metabolism. — 2007. — August (vol. 293, no. 2). — P. 444—452. — doi:10.1152/ajpendo.00691.2006. — PMID 17473055.
- ↑ Saito M., Okamatsu-Ogura Y., Matsushita M., Watanabe K., Yoneshiro T., Nio-Kobayashi J., Iwanaga T., Miyagawa M., Kameya T., Nakada K., Kawai Y., Tsujisaki M. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. (англ.) // Diabetes. — 2009. — July (vol. 58, no. 7). — P. 1526—1531. — doi:10.2337/db09-0530. — PMID 19401428.
- ↑ Graja A., Schulz T. J. Mechanisms of aging-related impairment of brown adipocyte development and function. (англ.) // Gerontology. — 2015. — Vol. 61, no. 3. — P. 211—217. — doi:10.1159/000366557. — PMID 25531079.
- ↑ Enerbäck S. The origins of brown adipose tissue. (англ.) // The New England Journal Of Medicine. — 2009. — 7 May (vol. 360, no. 19). — P. 2021—2023. — doi:10.1056/NEJMcibr0809610. — PMID 19420373.
- ↑ Mescher, 2016, p. 126.
- ↑ 1 2 Афанасьев и др., 2004, с. 231—232.
- ↑ 1 2 Harms M., Seale P. Brown and beige fat: development, function and therapeutic potential. (англ.) // Nature Medicine. — 2013. — October (vol. 19, no. 10). — P. 1252—1263. — doi:10.1038/nm.3361. — PMID 24100998.
- ↑ Heaton J. M. The distribution of brown adipose tissue in the human. (англ.) // Journal Of Anatomy. — 1972. — May (vol. 112, no. Pt 1). — P. 35—39. — PMID 5086212.
- ↑ Cohade C., Osman M., Pannu H. K., Wahl R. L. Uptake in supraclavicular area fat ("USA-Fat"): description on 18F-FDG PET/CT. (англ.) // Journal Of Nuclear Medicine : Official Publication, Society Of Nuclear Medicine. — 2003. — February (vol. 44, no. 2). — P. 170—176. — PMID 12571205.
- ↑ Yeung H. W., Grewal R. K., Gonen M., Schöder H., Larson S. M. Patterns of (18)F-FDG uptake in adipose tissue and muscle: a potential source of false-positives for PET. (англ.) // Journal Of Nuclear Medicine : Official Publication, Society Of Nuclear Medicine. — 2003. — November (vol. 44, no. 11). — P. 1789—1796. — PMID 14602861.
- ↑ van Marken Lichtenbelt W. D., Vanhommerig J. W., Smulders N. M., Drossaerts J. M., Kemerink G. J., Bouvy N. D., Schrauwen P., Teule G. J. Cold-activated brown adipose tissue in healthy men. (англ.) // The New England Journal Of Medicine. — 2009. — 9 April (vol. 360, no. 15). — P. 1500—1508. — doi:10.1056/NEJMoa0808718. — PMID 19357405.
- ↑ Shinoda K., Luijten I. H., Hasegawa Y., Hong H., Sonne S. B., Kim M., Xue R., Chondronikola M., Cypess A. M., Tseng Y. H., Nedergaard J., Sidossis L. S., Kajimura S. Genetic and functional characterization of clonally derived adult human brown adipocytes. (англ.) // Nature Medicine. — 2015. — April (vol. 21, no. 4). — P. 389—394. — doi:10.1038/nm.3819. — PMID 25774848.
- ↑ Lidell M. E., Betz M. J., Enerbäck S. Two types of brown adipose tissue in humans. (англ.) // Adipocyte. — 2014. — 1 January (vol. 3, no. 1). — P. 63—66. — doi:10.4161/adip.26896. — PMID 24575372.
- ↑ Mescher, 2016, p. 126—127.
- ↑ Fedorenko A., Lishko P. V., Kirichok Y. Mechanism of fatty-acid-dependent UCP1 uncoupling in brown fat mitochondria. (англ.) // Cell. — 2012. — 12 October (vol. 151, no. 2). — P. 400—413. — doi:10.1016/j.cell.2012.09.010. — PMID 23063128.
- ↑ Azzu V., Brand M. D. The on-off switches of the mitochondrial uncoupling proteins. (англ.) // Trends In Biochemical Sciences. — 2010. — May (vol. 35, no. 5). — P. 298—307. — doi:10.1016/j.tibs.2009.11.001. — PMID 20006514.
- ↑ Busiello R. A., Savarese S., Lombardi A. Mitochondrial uncoupling proteins and energy metabolism. (англ.) // Frontiers In Physiology. — 2015. — Vol. 6. — P. 36—36. — doi:10.3389/fphys.2015.00036. — PMID 25713540.
- ↑ Stanford K. I., Middelbeek R. J., Townsend K. L., An D., Nygaard E. B., Hitchcox K. M., Markan K. R., Nakano K., Hirshman M. F., Tseng Y. H., Goodyear L. J. Brown adipose tissue regulates glucose homeostasis and insulin sensitivity. (англ.) // The Journal Of Clinical Investigation. — 2013. — January (vol. 123, no. 1). — P. 215—223. — doi:10.1172/JCI62308. — PMID 23221344.
- ↑ Chondronikola M., Volpi E., Børsheim E., Porter C., Annamalai P., Enerbäck S., Lidell M. E., Saraf M. K., Labbe S. M., Hurren N. M., Yfanti C., Chao T., Andersen C. R., Cesani F., Hawkins H., Sidossis L. S. Brown adipose tissue improves whole-body glucose homeostasis and insulin sensitivity in humans. (англ.) // Diabetes. — 2014. — December (vol. 63, no. 12). — P. 4089—4099. — doi:10.2337/db14-0746. — PMID 25056438.
- ↑ Gerhart-Hines Z., Dominy Jr. J. E., Blättler S. M., Jedrychowski M. P., Banks A. S., Lim J. H., Chim H., Gygi S. P., Puigserver P. The cAMP/PKA pathway rapidly activates SIRT1 to promote fatty acid oxidation independently of changes in NAD(+). (англ.) // Molecular Cell. — 2011. — 23 December (vol. 44, no. 6). — P. 851—863. — doi:10.1016/j.molcel.2011.12.005. — PMID 22195961.
- ↑ Mescher, 2016, p. 125.
- ↑ Gospodarska E., Nowialis P., Kozak L. P. Mitochondrial turnover: a phenotype distinguishing brown adipocytes from interscapular brown adipose tissue and white adipose tissue. (англ.) // The Journal Of Biological Chemistry. — 2015. — 27 March (vol. 290, no. 13). — P. 8243—8255. — doi:10.1074/jbc.M115.637785. — PMID 25645913.
- ↑ Rosenwald M., Perdikari A., Rülicke T., Wolfrum C. Bi-directional interconversion of brite and white adipocytes. (англ.) // Nature Cell Biology. — 2013. — June (vol. 15, no. 6). — P. 659—667. — doi:10.1038/ncb2740. — PMID 23624403.
- ↑ Lo K. A., Sun L. Turning WAT into BAT: a review on regulators controlling the browning of white adipocytes. (англ.) // Bioscience Reports. — 2013. — 6 September (vol. 33, no. 5). — doi:10.1042/BSR20130046. — PMID 23895241.
- ↑ Harms M. J., Ishibashi J., Wang W., Lim H. W., Goyama S., Sato T., Kurokawa M., Won K. J., Seale P. Prdm16 is required for the maintenance of brown adipocyte identity and function in adult mice. (англ.) // Cell Metabolism. — 2014. — 1 April (vol. 19, no. 4). — P. 593—604. — doi:10.1016/j.cmet.2014.03.007. — PMID 24703692.
- ↑ Wang W., Kissig M., Rajakumari S., Huang L., Lim H. W., Won K. J., Seale P. Ebf2 is a selective marker of brown and beige adipogenic precursor cells. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2014. — 7 October (vol. 111, no. 40). — P. 14466—14471. — doi:10.1073/pnas.1412685111. — PMID 25197048.
- ↑ Kissig M., Shapira S. N., Seale P. SnapShot: Brown and Beige Adipose Thermogenesis. (англ.) // Cell. — 2016. — 30 June (vol. 166, no. 1). — P. 258—258. — doi:10.1016/j.cell.2016.06.038. — PMID 27368105.
- ↑ Shapira S. N., Lim H. W., Rajakumari S., Sakers A. P., Ishibashi J., Harms M. J., Won K. J., Seale P. EBF2 transcriptionally regulates brown adipogenesis via the histone reader DPF3 and the BAF chromatin remodeling complex. (англ.) // Genes & Development. — 2017. — 1 April (vol. 31, no. 7). — P. 660—673. — doi:10.1101/gad.294405.116. — PMID 28428261.
- ↑ Boström P., Wu J., Jedrychowski M. P., Korde A., Ye L., Lo J. C., Rasbach K. A., Boström E. A., Choi J. H., Long J. Z., Kajimura S., Zingaretti M. C., Vind B. F., Tu H., Cinti S., Højlund K., Gygi S. P., Spiegelman B. M. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. (англ.) // Nature. — 2012. — 11 January (vol. 481, no. 7382). — P. 463—468. — doi:10.1038/nature10777. — PMID 22237023.
- ↑ Brestoff J. R., Kim B. S., Saenz S. A., Stine R. R., Monticelli L. A., Sonnenberg G. F., Thome J. J., Farber D. L., Lutfy K., Seale P., Artis D. Group 2 innate lymphoid cells promote beiging of white adipose tissue and limit obesity. (англ.) // Nature. — 2015. — 12 March (vol. 519, no. 7542). — P. 242—246. — doi:10.1038/nature14115. — PMID 25533952.
- ↑ Mescher, 2016, p. 127.
- ↑ Mescher, 2016, p. 122.
- ↑ Furlong M. A., Fanburg-Smith J. C., Miettinen M. The morphologic spectrum of hibernoma: a clinicopathologic study of 170 cases. (англ.) // The American Journal Of Surgical Pathology. — 2001. — June (vol. 25, no. 6). — P. 809—814. — doi:10.1097/00000478-200106000-00014. — PMID 11395560.
- ↑ Obesity and overweight Fact sheet N°311. WHO (январь 2015). Дата обращения: 2 февраля 2016. Архивировано 22 апреля 2018 года.
- ↑ Giordano Antonio, Frontini Andrea, Cinti Saverio. Convertible visceral fat as a therapeutic target to curb obesity (англ.) // Nature Reviews Drug Discovery. — 2016. — 11 March (vol. 15, no. 6). — P. 405—424. — ISSN 1474-1776. — doi:10.1038/nrd.2016.31.
- ↑ Cannon B., Nedergaard J. Developmental biology: Neither fat nor flesh. (англ.) // Nature. — 2008. — 21 August (vol. 454, no. 7207). — P. 947—948. — doi:10.1038/454947a. — PMID 18719573.
- ↑ Lee Paul, Swarbrick Michael M., Ho Ken K. Y. Brown Adipose Tissue in Adult Humans: A Metabolic Renaissance (англ.) // Endocrine Reviews. — 2013. — 1 June (vol. 34, no. 3). — P. 413—438. — ISSN 0163-769X. — doi:10.1210/er.2012-1081.
Литература
править- Афанасьев Ю. И., Кузнецов С. Л., Юрина Н. А., Котовский Е. Ф. и др. Гистология, цитология и эмбриология. — 6-е изд., перераб. и доп. — М. : Медицина, 2004. — 768 с. — ISBN 5-225-04858-7.
- Anthony L. Mescher. Junqueira's Basic Histology : [англ.]. — McGraw-Hill Education, 2016. — ISBN 978-0-07-184270-9.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |