АТФ-синтаза
Аденозинтрифосфатсинта́за (АТФ-синта́за, АТФ-фосфогидролаза, H+-transporting two-sector ATPase) — группа ферментов, относящихся к классу транслоказ и синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганического фосфата. Название по номенклатуре — АТФ-фосфогидролаза, однако с августа 2018 года фермент перенесён из третьего (3.6.3.14) в седьмой класс (7.1.2.2[1]), так как катализируемая ферментом реакция протекает по пути, противоположному гидролизу, и не может быть описана с помощью других типов реакций, характеризующие прочие классы ферментов.
| АТФ-синтаза | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 7.1.2.2 |
| Номер CAS | 9000-83-3 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9000-83-3 |
В классификации ферментов реакция транслокации, осуществляемая АТФ-синтазой, описывается следующим уравнением:
- АТФ + H2O + 4 H+[side 1] = АДФ + Ф + 4 H+[side 2]
Энергию для синтеза АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например, из просвета тилакоида в строму хлоропласта или из межмембранного пространства (просвета кристы) в матрикс митохондрии. Реакция синтеза такова:
- АДФ + Фн → АТФ + H2O
АТФ-синтазы очень важны для жизнедеятельности почти всех организмов, так как АТФ относится к так называемым макроэргическим соединениям, при гидролизе которых происходит освобождение значительного количества энергии.
Антибиотик олигомицин подавляет активность FO-компонента АТФ-синтазы митохондрий.
Структура и номенклатура
правитьИмеющаяся в митохондриях АТФ-синтаза F1FO очень хорошо исследована.
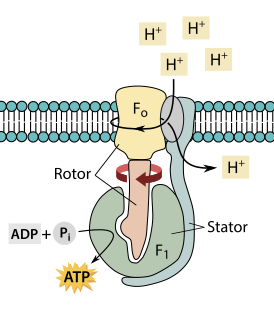
- компонент FO — трансмембранный домен,
- компонент F1 находится вне мембраны, в матриксе.
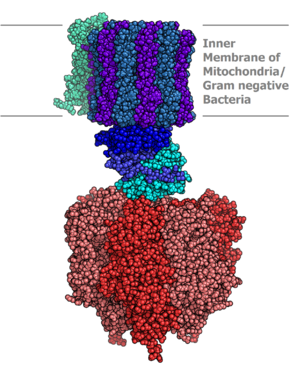
АТФ-синтазный комплекс FOF1 по форме напоминает плодовое тело гриба, у которого компонент F1 — это шляпка, ножка — это γ-субъединица компонента F1, а «корни» гриба — компонент FO, заякоренный в мембране.
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и FO. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса FO. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения FO, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода (ядер протия). Всего в состав комплекса FO входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9—12 копий субъединицы c (молекулярная масса 6—11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону FO субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Номенклатура фермента имеет традиционное происхождение, поэтому довольно непоследовательна.
Обозначение компонента F1 является сокращением от «Fraction 1» (часть 1), а символом FO (в индексе записана буква O, а не ноль) обозначался участок связывания олигомицина.
Некоторые субъединицы фермента имеют также буквенные обозначения:
- Греческие: α, β, γ, δ, ε
- Латинские: a, b, c, d, e, f, g, h
Другие — более сложные обозначения:
- F6 (от «Fraction 6»)
- OSCP — белок, чувствительный к олигомицину (от англ. the oligomycin sensitivity conferral protein), ATP5O
- A6L (названный так по названию гена, кодирующего его в митохондриальном геноме)
- IF1 (фактор ингибирования 1), ATPIF1
Компонент F1 достаточно велик (диаметр его составляет 9 нм), чтобы быть видимым в трансмиссионный электронный микроскоп при негативном окрашивании[2].
Частичками F1 усеяна внутренняя митохондриальная мембрана. Изначально считалось, что они содержат весь дыхательный аппарат митохондрии. Однако после долгих экспериментов группа Эфраима Рекера (впервые выделившая компонент F1 в 1961) показала, что эти частички связаны с АТФазной активностью в том числе и в разделённых митохондриях, и в субмитохондриальных частицах, формирующихся при ультразвуковом воздействии на митохондрии. Множество дальнейших исследований в разных лабораториях подтвердили эту АТФазную активность.
Модель синтеза АТФ: механический катализ
правитьВ 60—70 годах XX века Пол Бойер предположил, что синтез АТФ связан с изменениями конфигурации АТФ-синтазы, вызываемыми вращением γ-субъединицы, так называемый механизм изменения участка связывания («перевёртыш», англ. flip-flop). Исследовательской группе под руководством Джона Э. Уокера, относившейся тогда к Лаборатории молекулярной биологии в Кембридже, удалось выделить АТФ-синтазный каталитический комплекс F1 в кристаллической форме. На тот момент это была самая крупная из известных науке асимметричная белковая структура. Её исследования показали, что модель вращающегося катализа, предложенная Бойером, соответствует действительности. За это открытие Бойер и Уокер получили половину Нобелевской премии по химии в 1997 году. Вторую половину получил Йенс Кристиан Скоу «за первое открытие фермента, осуществляющего транспорт ионов — Na+,K+-аденозинтрифосфатазы».
Кристалл F1 состоит из перемежающихся α- и β-субъединиц (по 3 каждого вида), расположенных как дольки апельсина вокруг асимметричной γ-субъединицы. В соответствии с принятой моделью синтеза АТФ (также называемой моделью непостоянного катализа), градиент электрического поля, направленный поперёк внутренней митохондриальной мембраны и обусловленный электрон-транспортной цепью, заставляет протоны проходить сквозь мембрану через АТФ-синтазный компонент FO. Часть компонента FO (кольцо из c-субъединиц) вращается, когда протоны проходят через мембрану. Это c-кольцо жёстко связано с асимметричной центральной ножкой (состоящей в основном из γ-субъединицы), которая в свою очередь вращается внутри α3β3-участка компонента F1. Это приводит к тому, что три участка катализа, связывающиеся с нуклеотидами, претерпевают изменения в конфигурации, приводящие к синтезу АТФ.
Основные субъединицы (α3β3) компонента F1 соединены дополнительной боковой ножкой с неподвижным участком FO, что предотвращает их вращение вместе с γ-субъединицей. Структура неповрёжденной АТФ-синтазы с низкой точностью выявлена при помощи электронной криомикроскопии (ЭКМ). Показано, что боковая ножка — это гибкая перемычка, похожая на канат, наматывающаяся на комплекс во время его работы.
При каждом обороте γ-субъединицы на 3600 синтезируются три молекулы АТФ, При этом, видимо, у разных организмов из межмембранного пространства в матрикс проходит от 10 до 14 протонов — по числу с-субъединиц[3].
В определённых условиях каталитическая реакция может протекать в обратном направлении, при этом гидролиз АТФ вызывает прокачку протонов через мембрану.
В механизме изменения участка связывания задействован активный участок β-субъединицы, последовательно проходящий через три состояния[4].
В «открытом» состоянии АДФ и фосфат подходят к активному участку. Затем белок охватывает эти молекулы и свободно связывается с ними («свободное» состояние). Следующее изменение формы белка прижимает молекулы друг к другу («тесное» состояние), что приводит к формированию АТФ. Наконец, активный участок снова переходит в «открытое» состояние, освобождает АТФ и связывает следующую молекулу АДФ и фосфата, после чего цикл производства АТФ повторяется.
Физиологическое значение
правитьКак и у многих других ферментов, действие АТФ-синтазы F1FO обратимо. Большие концентрации АТФ заставляют её расщеплять АТФ и создавать трансмембранный протонный градиент. Такое использование АТФ-синтазы отмечено у анаэробных бактерий, не имеющих электрон-транспортной цепи. Эти бактерии применяют гидролиз АТФ для создания протонного градиента, который задействован в движении жгутиков и клеточном питании.
У аэробных бактерий в нормальных условиях АТФ-синтаза, как правило, работает в обратном направлении, производя АТФ за счёт энергии электрохимического потенциала, создаваемого электрон-транспортной цепью. В целом данный процесс называется окислительным фосфорилированием. Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1 находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
АТФ-синтаза у разных организмов
правитьАТФ-синтаза растений
правитьУ растений АТФ-синтаза CF1FO присутствует в хлоропластах. Она встроена в мембрану тилакоида, причём компонент CF1 выступает в строму, где протекают темновые реакции фотосинтеза (также называемые светонезависимыми реакциями цикла Кальвина). Структура и механизм катализа АТФ-синтазы хлоропластов почти такая же, как и в митохондриях. Однако электрохимический потенциал у хлоропластов формируется не дыхательной электрон-транспортной цепью, а другими комплексами — фотосистемой II и цитохромным комплексом b6/f.
АТФ-синтаза E. coli
правитьАТФ-синтаза кишечной палочки — самая простая из всех известных АТФ-синтаз. Она состоит всего из 8 видов субъединиц.
АТФ-синтаза дрожжей
правитьНапротив, АТФ-синтаза дрожжей — самая сложная из известных. Она состоит из 20 различных видов субъединиц.
Эволюция АТФ-синтазы
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Эволюция АТФ-синтазы считается примером модульной эволюции, при которой две субъединицы, каждая обладающая своими функциями, соединились и получили новые функции.
Гексамер α3β3, входящий в состав компонента F1 проявляет существенное сходство с гексамерной ДНК-геликазой. Оба типа ферментов образуют кольцо с вращательной симметрией 3 порядка, обладающее центральной по́рой. Действие каждого из них также зависит от относительного вращения макромолекулы внутри поры: геликазы используют спиральную форму ДНК для движения вдоль неё и для обнаружения суперскручивания, тогда как α3β3-гексамер использует изменения своей конфигурации из-за вращения γ-субъединицы для осуществления каталитической реакции.
Протонный мотор компонента FO проявляет большое функциональное сходство с протонными моторами жгутиков. И там, и там присутствует кольцо из множества небольших богатых α-спиралями белков, вращающихся относительно соседних неподвижных белков за счёт энергии протонного градиента. Это, конечно, очень зыбкое сходство, так как структура жгутиковых моторов гораздо сложнее, чем FO, а вращающееся белковое кольцо гораздо крупнее и состоит из 30 субъединиц против 10, 11 или 14, входящих в состав компонента FO.
Теория молекулярной эволюции предполагает, что две субъединицы с независимыми функциями — ДНК-геликаза с дополнительным АТФ-азным действием и протонный мотор — смогли соединяться, причём вращение мотора вызывало проявление АТФ-азной активности геликазы. Или же, наоборот, в первичной связке ДНК-геликазы и протонного мотора гидролиз АТФ на геликазе заставлял работать протонный мотор. Это соединение затем постепенно оптимизировалось, получило возможность катализировать обратную реакцию и через какое-то время превратилось в сложную АТФ-синтазу, существующую в настоящее время. Однако, до сих пор неясен механизм происхождения протонного мотора, который без геликазы или других комплексов не представляет никакой пользы.
См. также
правитьПримечания
править- ↑ Международный союз биохимии и молекулярной биологии. EC 7.1.2.2. IUBMB Enzyme Nomenclature (август 2018). Дата обращения: 13 ноября 2018. Архивировано 14 ноября 2018 года.
- ↑ Fernandez-Moran et al., Journal of Molecular Biology, Vol 22, p 63, 1962
- ↑ Протонный градиент АТФ-синтазы Архивная копия от 4 января 2015 на Wayback Machine (англ.)
- ↑ Gresser M.J., Myers J.A., Boyer P.D. Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model (англ.) // J. Biol. Chem. : journal. — 1982. — Vol. 257, no. 20. — P. 12030—12038. — PMID 6214554. Архивировано 29 сентября 2007 года.
- ↑ K. Kinosita, Jr. R. Yasuda, H. Noji, K. Adachi. А rotary molecular motor that can work at near 100% efficiency. Philos Trans R Soc Lond B Biol Sci. 2000 April 29; 355(1396): 473—489. Дата обращения: 20 сентября 2016. Архивировано 2 октября 2015 года.
Литература
править- Ю. М. Романовский, А. Н. Тихонов. Молекулярные преобразователи энергии живой клетки. Протонная АТФ-синтаза — вращающийся молекулярный мотор // УФН. — 2010. — Т. 180. — С. 931—956.
Ссылки
править- «АТФ-синтаза — чудесная молекулярная машина» (англ.)
- Хорошо проиллюстрированная лекция об АТФ-синтазе, прочитанная Энтони Крофтсом в Университете Иллинойса в Урбана-Шампен (англ.)
- Протонные и натриевые насосы-АТФазы типа F, V и A в базе данных OPM (англ.)
- Нобелевская премия по химии за 1997 год, присуждённая Полу Д. Бойеру и Джону Э. Уокеру за открытие ферментного механизма синтеза АТФ, и Йенсу К. Скоу за открытие ионно-транспортного фермента Na+, K±АТФазы (англ.)
- Harvard Multimedia Production Site — видеоролик, показывающий синтез АТФ