Эмбриональная диапауза (др.-греч. ἔμβρυον — зародыш и διάπαυσις — перерыв) — феномен глубокой задержки развития эмбриона, происходящей при нормальном ходе его развития[1]. От вида к виду стадия онтогенеза, на которой происходит задержка, сильно различается. Внешние условия влияют на эмбриональную диапаузу опосредованно; она не вызывается непосредственно неблагоприятными внешними воздействиями.[2][3]. У плацентарных этот процесс чаще называют задержанной имплантацией[4].
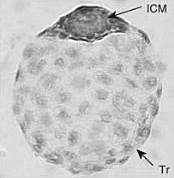
Обнаружена у видов, принадлежащих к несвязанным таксономическим группам — от насекомых и до млекопитающих[2][5]: у коловраток, низших ракообразных, саранчовых, тутового шелкопряда[6], у птиц и рыб[1], у около сотни видов млекопитающих, относящихся к разным отрядам, например, у грызунов и хищных[4]. У растений есть схожий механизм, который называется периодом покоя семян[англ.][5].
Может происходить на разных стадиях развития эмбриона. Так, для насекомых различают ранне-, средне- и позднеэмбриональную диапаузу. У подавляющего большинства млекопитающих диапауза происходит только на одном этапе развития — на стадии бластоцисты перед имплантацией в стенку матки.[2]
Определяющим свойством эмбриональной диапаузы у растений и животных является кардинальное уменьшение числа или прекращение митозов (разновидности клеточного деления) в эмбрионе, которое может происходить на фазе G0/G1 или G2 клеточного цикла. Возобновление деления означает прекращение диапаузы.[2]
Эволюционное значение
правитьОсобенности протекания эмбриональной диапаузы существенно различаются от вида к виду, что даёт основания утверждать, что её распространённость вызвана не только филогенетическими связями, но и независимым возникновением у разных видов в ходе эволюции, по причине того, что в некоторых экологических ситуациях она даёт серьёзные селективное преимущество. Природа этого преимущества для большинства таксонов не выявлена, и ещё меньше известно об эволюционных связях механизма диапаузы среди современных видов.[7]
Как эволюционный механизм эмбриональная диапауза позволяет разнести по времени процессы оплодотворения и активного развития эмбриона. Это даёт возможность производить оба процесса в наиболее благоприятные для данного вида моменты, что повышает выживаемость потомства[8], вплоть до того, что у некоторых видов зародыши в состоянии эмбриональной диапаузы выживают в условиях, в которых взрослые особи существовать не способны — например, у рыб и рачков в полностью высыхающих водоёмах[9] или пройдя через желудочно-кишечный тракт хищника[10]:270.
История изучения
правитьПо всей видимости, первое упоминание задержанной имплантации (эмбриональной диапаузы у млекопитающих) сделано в середине первой декады 17-го века в полевых заметках Уильяма Гарвея, написанных при сопровождении короля Англии Карла I в его поездке, связанной с охотой на косуль.[11] Считается, что первое научное описание задержанной имплантации дал Бишофф (Bischoff) в 1854 году[K 1], изучая европейских косуль[12][13]. Иногда приоритет признаётся за Циглером (Ziegler), 1843 год[K 2][13].
Эмбриональная диапауза у насекомых изучалась вместе с другими видами диапаузы (личиночной и имажинальной).[14]
Термин «диапауза» был введён Уилером в 1893 году для описания некоторых состояний при развитии эмбриона длинноусых прямокрылых (Xiphidium ensiferum). В его работе под диапаузой понималась стадия покоя между разнонаправленными движениями эмбриона в желтке. Новое значение термину дал Геннеги (Henneguy) в статье 1904 года; в ней под диапаузой понималось состояние остановки развития как эмбриона, так и взрослого насекомого. Выделение двух типов диапаузы — факультативной и облигатной — было предложено Стейнбергом (Steinberg) и Каменски (Kamensky) в 1936 году.[15]
Для эмбриональной паузы у членистоногих часто используется термин «яйцевая диапауза» (англ. egg diapause, ovarian diapause).[16] Предположения о том, что эмбриональная диапауза может быть связана с гормонами, встречаются в работах Копеца (Kopec) 1917-го и 1922-го годов.[17] В 1924 японский исследователь Ватанабе (Watanabe) пришёл к выводу, что диапауза у яиц шелкопряда связана с получением «ингибирующего» вещества от материнского мотылька.[18] Изучение связанных с эмбриональной диапаузой гормональных процессов тутового шелкопряда (Bombyx mori) связано с именами следующих исследователей: Фукуда (Fukuda), Кинсаку Хасэгава (Kinsaku Hasegawa), Лис (Lees) и де Вилд (de Wilde).[17] Фукуда и Хасэгава независимо друг от друга 1951 году сообщили выводы о нейрогормональном механизме управления диапаузой.[19][20] В начале 1990-х структура «гормона диапаузы» была выявлена[16]. Однако, по всей видимости, этот механизм диапаузы не является универсальным для насекомых[21].
Термин «эмбриональная диапауза» (англ. embryonic diapause) был предложен австралийским зоологом Сесилем Хью Тиндэйл-Биско (Cecil Hugh Tyndale-Biscoe) в 1963 году в работе «Роль жёлтого тела в задержанной имплантации у сумчатых»[22]. Его предложение основывалось на том, что у сумчатых возобновившая развитие бластоциста, в отличие от плацентарных млекопитающих, имплантируется в стенку матки не сразу, в связи с чем ранее использованный термин «задержанная имплантация» (англ. delayed implantation) неточно описывал процесс.[23]. Позже термин был распространён на всех млекопитающих и другие организмы.[4]
Дискуссия о разнообразии проявлений задержанной имплантации у близкородственных видов в 1980-х связывается с именами Микаэля Санделла (Mikael Sandell) и Кэролин Кинг (Carolyn M. King).[11] В их работах рассматривался вопрос, почему у горностая (Mustela erminea) эмбриональная диапауза наблюдается, а у малой ласки (Mustela nivalis) — нет.[24] Тщательный обобщающий анализ был сделан в начале 2000-х годов Майклом Томом (Michael Thom) и другими учёными на основе построения филогенетического дерева куньих[1]:112.
Покой семян у растений
правитьЭмбриональная диапауза у растений называется покоем семян[5]. Под ним понимается состояние жизнеспособных семян, при котором они не прорастают. Если причиной покоя являются отсутствие условий для прорастания, такое состояние называется вынужденным покоем. Покой, связанный с особыми свойствами зародышей, называется органическим и проявляется в отсутствии прорастания или снижения всхожести при благоприятных для прорастания внешних условиях.[25]
Существует три основных типа органического покоя семян[26]:
- Морфологический — семена выпадают незрелыми, и перед прорастанием требуется некоторый период роста или дифференцировки.
- Физический — семена имеют водонепроницаемую оболочку, и для прорастания требуется нарушение её целостности.
- Физиологический — покой сохраняется до того момента, как в зародыше произойдут химические изменения.
Типы покоя могут совмещаться в одном семени. Широко распространён морфофизиологический покой — то есть одновременно относящийся и к морфологическому, и к физиологическому типу. Сочетание физического и физиологического покоя встречается редко, а сочетание морфологического типа с физическим невозможно.[26]
Функциями покоя семян являются предотвращение всхода семян в условиях, которые благоприятны для всхода, но неблагоприятны для последующего роста и выживания растения, а также увеличение разнообразия вариантов развития — распространение семян в более широких ареалах и разновременный всход семян.[5]
У некоторых растений семена в состоянии покоя могут находиться очень продолжительное время, вплоть до тысяч лет. Так, в 1951 году на северо-востоке Китая были обнаружены семена лотоса примерно тысячелетнего возраста, которые оказались жизнеспособны[27].
Эмбриональная диапауза у членистоногих
правитьСреди беспозвоночных эмбриональная диапауза обнаружена у различных видов насекомых, ракообразных, и паукообразных (клещей)[28][29].
Диапауза (как эмбриональная, так и имажинальная) широко распространена среди членистоногих и изучена у веслоногих (дафний и артемий); клещиков паутинных, и различных насекомых. Несмотря на то, что диапауза у членистоногих широко изучается в течение более полувека, на 2010 механизмы её регуляции до конца не поняты[30].
Эмбриональная диапауза у насекомых
правитьУ насекомых эмбриональная диапауза может происходить на различных стадиях развития эмбриона. Часто она называется «яйцевой диапаузой» (англ. egg diapause, ovarian diapause).[16]
- Раннеэмбриональная (на ранних стадиях развития эмбриона).
- Среднеэмбриональная (на поздних стадиях развития эмбриона, после формирования нейроэндокринной системы).
- Позднеэмбриональная (полностью развившаяся личинка, до выхода из яйцевой оболочки).[14]
Однако у большинства видов диапауза происходит только на одной из указанных стадий.[31]
В регионах с большими перепадами температуры диапауза позволяет пережить морозные зимы, либо периоды засухи за счёт большей устойчивости находящегося в состоянии диапаузы эмбриона к неблагоприятным условиям по сравнению со взрослыми особями.[31]
Механизм диапаузы позволяет синхронизировать вылупление взрослых особей, увеличивая шансы на спаривание. Такая синхронизация важна, например, для долгоживущих видов наподобие дозорщиков, у которых личиночная стадия продолжается два лета, при этом скорость развития отдельных особей существенно различается.[31]
Во многих случаях течение диапаузы определяется фотопериодом, испытанным материнским организмом. У некоторых видов, к примеру, у тутового шелкопряда (Bombyx mori) или волнянки античной (Orgyia antiqua) эмбриональная диапауза задаётся эмбриону «гормоном диапаузы», который вырабатывается в подглоточном ганглии матери и передаётся яйцу.[16]
Наиболее подробно механизм эмбриональной диапаузы у насекомых был изучен у тутового шелкопряда (Bombyx mori). Вероятно, именно на этом организме лучше всего изучены механизмы подавления диапаузы.[17] У ряда видов тутового шелкопряда наблюдается облигатная диапауза, такие виды являются моновольтинными. У других наблюдается факультативная диапауза, и они могут давать несколько поколений в течение одного года. Будет ли эмбрион такого вида проходить через стадию диапаузы, зависит от фотопериода, в течение которого развивался эмбрион его матери. Если эмбриональное развитие матери проходило в период высоких температур и большой продолжительности дня, то откладываемые ею яйца будут проходить через диапаузу на ранних стадиях развития. Если мать развивалась в период низких температур и коротких дней, её яйца будут развиваться без диапаузы. Таким образом, родившиеся весной, когда дни коротки, дадут потомство, выросшее летом и без диапаузы. Оно, в свою очередь, отложит яйца, которые пройдут через диапаузу и таким образом переживут зиму, чтобы развиться весной. В результате, такие виды оказываются бивольтинными, дающими два поколения в год.[20]
Эндокринная связь между фотопериодом при развитии матери и диапаузой её яиц была выявлена Фукудой и Хасегавой в 1951 году.[18] Гистологическими методами они показали, что если развитие зародышей и ранних личинок тутового шелкопряда при сравнительно высокой температуре (25 °C) и длинном световом дне, то в подглоточном ганглии развившихся из них куколок может быть выделен особый гормон диапаузы (обозначаемый DH). Он приводит к увеличению содержания в их яйцах гликогена и пигмента; такие яйца в своём развитии проходят через стадию диапаузы. Введение этого гормона женским куколкам приводит к тому, что они откладывают как диапазирующие, так и недиапазирующие яйца вне зависимости от того, какие яйца должны были быть отложены по условиям собственного развития.[20][32]
В 1991 году гормон диапаузы тутового шелкопряда был выделен и синтезирован Имаи. Гормон имеет молекулярную массу 2645 а. е. м.[33], состоит из 24 аминокислот (TDMKDESDRGAHSERGALWFGPRL-амид), с амидированием на карбоксильном конце.[28]
Однако маловероятно, что регуляция эмбрионального развития посредством гормона диапаузы является универсальным механизмом среди насекомых. Этот пептид был найден только у некоторых представителей чешуекрылых (Lepidoptera)[21].
Эмбриональная диапауза у ракообразных
правитьОдним из предметов изучения является рачок Artemia franciscana. Его диапазирующий эмбрион, также называемый цистой, способен выживать в экстремальных условиях[34]. При комнатной температуре его диапазирующие эмбрионы могут обходиться без кислорода годами[35]:306.
На наступление и окончание эмбриональной диапаузы у ракообразных оказывают влияние различные факторы. Однако основным из них является фотопериод — сезонные изменения продолжительности светового дня (например, для ветвистоусых раков (Cladocera), для Diaptomus sanguineus). Существуют и другие факторы, но обычно они действуют совместно с фотопериодом.[10]:272-273 На выход из эмбриональной диапаузы влияют также различные факторы — изменения температуры, фотопериода и концентрации кислорода. Эти факторы действуют как на продолжительность летней, так и зимней диапаузы, но имеют различную степень важности. Так, фотопериод более важен для окончания летней диапаузы, а изменение температуры — зимней.[10]:278
Эмбриональная диапауза способствует распространению многих ракообразных с балластными водами при судоходстве. И, возможно, именно эта физиологическая особенность позволила некоторым исходно морским видам раков заселить континентальные водоемы[36]:58.
У тех десятиногих ракообразных, у которых наблюдалась эмбриональная диапауза, она происходила в фазе гаструлы[37]:43.
У лат. Corystes cassivelaunus и Hyas coarcticus, имеющих одни из самых длительных периоды инкубации среди крабов - в 10 месяцев - эмбриональная диапауза обнаружена, и предполагается, что она возникла для увеличения выживаемости личинок, обеспечивая их развитие в периоды, когда пища максимально доступна[38]:759.
Эмбриональная диапауза у позвоночных
правитьПо всей видимости, у ряда различных представителей позвоночных эмбриональная диапауза возникла независимо в ходе эволюции в результате того, что виды, развитие зародышей которых могло приостанавливаться в зависимости от внешних условий, получили селективное преимущество:
- во-первых, диапауза позволяет задержать развитие эмбриона до того момента, пока внешние условия не станут более благоприятными для его выживания;
- во-вторых, диапауза позволяет увеличить промежуток времени между оплодотворением и рождением без изменения скорости процессов активного развития эмбриона.
Наблюдается среди карпозубых, черепах, сумчатых и высших зверей.[9]
Яркие примеры диапаузы обнаружены у ряда карпозубых Африки и Южной Америки: представители родов Austrofundulus, Aphyosemion, Cynolebias, Nothobranchius живут в водоёмах, которые существуют только в сезон дождей и полностью высыхают в остальное время. Взрослые особи мечут икру в сезон дождей, и эмбрионы погружаются в ил на глубине водоёма. С его высыханием все взрослые особи умирают, но клетки эмбрионов перед полным обезвоживанием частично отделяются друг от друга, рассеиваются и впадают в длительную диапаузу. Эта подготовка позволяет эмбрионам избежать полного иссушения посредством механизма, который пока ещё не изучен. Когда водоём в сезон дождей наполняется водой, смачивание эмбрионов водой восстанавливает их целостность, и их развитие возобновляется[9]:250.
Другая форма диапаузы наблюдается у некоторых видов морских черепах, у которых спаривание и оплодотворени может происходить за 3000 км до мест гнездовья. Развитие зародыша останавливается на стадии нейрулы на период миграции. В этой ситуации самка несёт в себе зародыш, не тратя энергию на поддержку его развития. Как только самка откладывает такие зародыши в виде «яиц», они продолжают свою программу развития в гнезде[9]. Для части черепах характерно два периода эмбриональной диапаузы. Первый, происходящий до откладывания яиц, также называют "первичной диапаузой" или "расширением предяйцекладной задержки" (англ. extension of preovipositional arrest); он широко распространён среди черепах. Второй, наблюдаемый после откладывания яиц, называется собственно эмибриональной диапаузой[39].
У многих видов диапауза выражается только в уменьшении митотической активности на ранних стадиях развития эмбриона, а на последующие процессы развития влияния почти не оказывается.[9] У подавляющего большинства млекопитающих скорость развития эмбриона не зависит от температуры, у остальных позвоночных и некоторых рукокрылых — зависит.[40]
Эмбриональная диапауза у млекопитающих
правитьУ подавляющего большинства млекопитающих задержка развития эмбриона происходит только перед имплантацией в стенку матки. Для плацентарных эта задержка традиционно часто называется «задержанной имплантацией», для сумчатых используется название «эмбриональная диапауза», так как возобновившая своё развитие бластоциста у них имплантируется в матку не сразу, в отличие от плацентарных[23].
Также у многих видов рукокрылых наблюдается задержка в развитии эмбриона после имплантации. Она называется «задержанное развитие» (англ. delayed development), обнаружена и среди представителей летучих мышей, и среди представителей крыланов.[11] У коротконосых крыланов (Cynopterus sphinx) этот процесс регулируется мелатонином.[41]
Различают обязательную (облигатную, сезонную) и факультативную (необязательную, лактационную) эмбриональную диапаузу. В первом случае диапауза происходит в ходе каждой беременности (в частности, в определённое время года), а во втором случае — в условиях метаболического стресса (преимущественно при лактации).[2][4]
Из сумчатых, эмбриональная диапауза наблюдается у всех кенгуру, валлаби, и кенгуровых крыс, за исключением западного серого кенгуру (Macropus fuliginosus), кенгуру Лумхольтца (Dendrolagus lumholtzi) и кенгуровой мускусной крысы (Hypsiprymnodon moschatus), а также встречается у некоторых видов карликовых кускусов, карликовых летучих кускусов, и поссумов-медоедов. Даже у хищных сумчатых, у которых диапауза как таковая не наблюдается, в процессе развития бластоцисты происходит существенное изменение. Механизм регуляции диапаузы подробно изучен только для таммаров (Macropus eugenii).[42]
Некоторым видам присущи оба механизма диапаузы — и обязательная, и факультативная, и они проявляются в зависимости от времени года. К таким видам относятся, например, таммары; механизм регуляции разных видов диапаузы различен: двустороннее удаление шейного ганглия у самок таммара устраняет сезонную эмбриональную диапаузу, но не оказывает влияния на лактационную.[43]
Задержанная имплантация у млекопитающих
править| Филогенетическое дерево для куньих.[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Обозначения: |
Задержанная имплантация — задержка развития эмбриона ряда плацентарных на стадии бластоцисты перед имплантацией в стенку матки. Корректность термина «задержанная имплантация» была поставлена под сомнение, но он продолжает использоваться наряду с предложенным для его замены термином «эмбриональная диапауза»[4].
Задержанная имплантация происходит не из-за случайного неприкрепления зародыша к слизистой оболочке матки, а из-за ингибирующего влияния матки на развитие бластоцист.[44] Развивающееся яйцо, пройдя в яйцеводах период дробления и достигнув стадии бластоцисты, попадает в полость матки. Здесь оно некоторое время находится во взвешенном положении в жидкости просвета матки, без контакта с эпителием матки. У разных млекопитающих такая ситуация может длиться от нескольких часов (у хомяков) и 2—3 дней (у человека) до нескольких месяцев (у соболя, броненосца и других) — последний упомянутый случай сопровождается эмбриональной диапаузой. Для начала процесса имплантации в матке должны произойти как общие изменения, определяющиеся гормональным фоном, так и локальные, связанные со взаимодействием с бластоцистой. В районе контакта с эмбрионом (или небольшого расстояния до него) клетки соединительно-тканной стромы матки преобразуются в децидуальные клетки. Вероятно, наряду с другими факторами, решающую роль в данном процессе играют иммунологические факторы.[45]
Морфология остановившегося в развитии эмбриона различна у разных видов из числа тех, у которых происходит задержанная имплантация. У многих из них эмбрион перед диапаузой проходит процесс хетчинга, при этом количество клеток в нём может составлять от 30—40 у косуль и 130 у мышей до 700 у девятипоясных броненосцев.[2]
Задержанная имплантация была обнаружена у около сотни видов млекопитающих, относящихся к 7 отрядам, в 17 из 139 семейств[K 3]: у парнокопытных (Artiodactyla), сумчатых (Marsupalia), насекомоядных (Insectivora), рукокрылых (Chiroptera), неполнозубых (Edentata), хищных (Carnivora) и грызунов (Rodentia).[13] (В ряде источников со ссылкой на Айткена указывается цифра 8 отрядов; это связано с тем, что ранее ластоногие (pinnipeds) относились к отдельному отряду.)[12] Облигатная диапауза выявлена по меньшей мере у 53 видов в 7 отрядах, 10 семействах[K 3]; при этом почти половина из этих видов относится к одному семейству — куньих. Задержанная имплантация наблюдается у 34 % куньих, в то время как в целом по млекопитающим она выявлена только для менее чем 0,05 %, что делает куньих предметом особого интереса исследователей.[4][7]
Распространение задержанной имплантации среди млекопитающих носит нерегулярный характер. Значительное число подсемейств и даже родов включают как виды, у которых она наблюдается, так и виды, у которых её нет. Яркими примерами таких пар родственных видов, часто имеющих сходную среду обитания, но различающихся наличием и отсутствием задержанной имплантации, являются: канадская выдра (Lontra canadensis) и выдра обыкновенная (Lutra lutra); горностай (Mustela erminea) и ласка (Mustela nivalis); западный (Spilogale gracilis) и восточный (Spilogale putorius) пятнистые скунсы (в каждой паре сначала идёт вид, у которого эмбриональная диапауза есть).[7]
Существует подтверждённая исследованиями гипотеза, что задержанная имплантация преимущественно встречается в климате с выраженными сезонами, а также у долгоживущих организмов[7]. Задержанная имплантация позволяет разнести процессы спаривания и вынашивания, фактически увеличивая период беременности. Это даёт возможность производить оба процесса в наиболее благоприятные для данного вида моменты, что повышает выживаемость потомства[8].
Гипотезы о возможности задержанной имплантации у человека
правитьНесмотря на отсутствие прямых свидетельств того, что человеческий эмбрион может входить в состояние диапаузы, нельзя исключать возможность этого при определённых обстоятельствах.[46]
Если удастся разработать метод искусственно вызывать диапаузу, это может увеличить:[46]
- выживаемость эмбрионов после различных процедур;
- вероятность имплантации экстракорпорально оплодотворённого (ЭКО) эмбриона.
В нескольких исследованиях обнаружены задержки выработки хорионического гонадотропина при маточных и внематочных беременностях, хотя эти задержки скорее могут быть объяснены задержками в развитии, а не диапаузой.[47]
В исследовании 1996 года описан случай задержки имплантации на 5 недель после ЭКО. Процесс проходил в условиях клиники с регулярным измерением уровня хорионического гонадотропина и проведением УЗИ. Эта пациентка ранее родила четырёх детей, причём основываясь на дате последней менструации, третий ребёнок родился на пять недель, а четвёртый — на две недели позже обычного срока человеческой беременности.[46]
Исследования в этом направлении затруднены этическими соображениями. Исследования на макаках показали, что введение диклофенака (ингибитор синтеза простагландина) вместе с мисопростолом (аналог простагландина Е1) приводят к задержке имплантации до 6 суток, однако не было показано, что задержка вызвана именно диапаузой.[47]
Механизм задержанной имплантации
правитьВ каждом семействе млекопитающих характеристики диапаузы различны, и регулирующие её факторы могут быть различными: диапауза может носить лактационный или сезонный характер, основываться на выработке эстрогена или прогестерона, зависеть от фотопериода или изменения состава пищи. Одним из основных гормонов, определяющих эндокринную картину у многих видов, является пролактин; однако он может как стимулировать, так и ингибировать жёлтое тело.[8]
← 4-OH-E2 (ПГE2) (цАМФ) |
||
EGFR ↑ ; COX-2 ↑ ; H2-R ↑ CB1 ↓ |
EGFR ↓ ; COX-2 ↓ ; H2-R ↓ CB1 ↑ | |
| Молекулярные маркеры остановки и возобновления развития бластоцисты грызунов:
| ||
Так, секретирование пролактина гипофизом предотвращает имплантацию у таммаров, но форсирует возобновление развития и имплантацию у норок и пятнистых скунсов. Удаление яичников (овариэктомия) — предотвращает диапаузу у куньих, но форсирует у армадиллов. Функция жёлтого тела остаётся постоянной у косуль и армадилло, но оно не завершает дифференциацию и выделяет низкий уровень прогестерона у хищных. Прогестерон вызывает имплантацию у таммаров, но у грызунов для этого требуется эстроген. У хищных же, по всей видимости, ни прогестерон, ни эстроген не может стимулировать имплантацию.[40]
В регулировании сезонной диапаузы участвует мелатонин. Наиболее изучено его влияние для западных пятнистых скунсов, таммаров и норок, у которых удаление или денервация шишковидной железы приводит к отсутствию сезонной эмбриональной диапаузы, а введение мелатонина влияет на длительность диапаузы. Однако, по всей видимости, мелатонин не оказывает прямого воздействия на эмбрион, а вызывает изменение нейроэндокринной регуляции матери.[48]
В период задержанной имплантации матка находится в состоянии покоя. Молекулярные механизмы, регулирующие процесс задержанной имплантации, изучены слабо.[49]
На мышах и крысах проводили овариэктомию перед моментом выброса значительных количеств эстрогена, что приводило к развитию диапаузы бластоцисты в просвете матки. У грызунов состояние задержанной имплантации можно поддерживать продолжительное время при помощи прогестерона. При этом единичная инъекция эстрогена приводит к стремительной активации бластоцисты. Несмотря на то, что механизм регуляции этого процесса эстрогеном изучены мало, выявлены некоторые молекулярные маркеры[49].
Несмотря на наличие морфологических различий между бластоцистой в нормальном состоянии и в состоянии диапаузы, некоторые из молекулярных маркеров обратимо регулируют её стадии развития[49]. Так, 4-гидроксиэстрадиол (4-OH-E2), простагландин E2 (ПГЕ2) и цАМФ могут активировать покоящуюся бластоцисту in vitro и активировать, либо подавлять проявление маркеров, как указанно на иллюстрации. Если нормальная бластоциста переходит в состояние диапаузы перед прикреплением в матке, аналогичный процесс происходит в обратном направлении[49].
Список видов с выявленной эмбриональной диапаузой
править| Вид | Длительность диапаузы |
Источник |
|---|---|---|
| Ракообразные | ||
| Десятиногие ракообразные | ||
| Большой сухопутный краб | 8 недель | [38]:751 |
| Corystes cassivelaunus | 14 недель | [38]:751 |
| Hyas coarcticus | 16 недель | [38]:751 |
| Lopholithodes foraminatus | 12 месяцев | [37]:13 |
| Maia squinado | 6 недель | [38]:751 |
Комментарии
править- ↑ В работе Bischoff, T. L. W. Entwicklungsgeschichte des Rehes. (неопр.). — Rickersche Buchhandlung Gießen, 1854.
- ↑ Основываясь на следующей его работе: Ziegler, L. Beobachtungen über die Brunst und den Embryo der Rehe.. — Hannover: Hellweg`sche Hofbuchhandlung, 1843.
- ↑ 1 2 Систематика периодически меняется. Указываемые числа — ориентировочные.
Источники информации
править- ↑ 1 2 3 John C. Avise. Evolutionary Pathways in Nature: A Phylogenetic Approach (неопр.). — Cambridge University Press 2006. — P. 110. — 298 p. — ISBN 0521674174.
- ↑ 1 2 3 4 5 6 Flavia L. Lopes, Joëlle A. Desmarais and Bruce D. Murphy. Embryonic diapause and its regulation (англ.) // Reproduction. — 2004. — Вып. 128. — P. 669—678. Архивировано 6 сентября 2008 года.
- ↑ Egg incubation: its effects on embryonic development in birds and reptiles. — Cambrige University Press.
- ↑ 1 2 3 4 5 6 Mikael Sandell. The evolution of seasonal delayed implantation (англ.) // The Quarterly Review of Biology. — Mar., 1990. — Т. 65, № 1. — P. 23—42.
- ↑ 1 2 3 4 František Baluška. Plant-Environment Interactions. From Sensory Plant Biology to Active Plant Behavior (неопр.). — Springer, 2009. — P. 107. — ISBN 978-3-540-89229-8.
- ↑ Диапауза / В. А. Свешников // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ 1 2 3 4 5 Michael D. Thom, Dominic D. P. Johnson and David W. Macdonald. The Evolution and Maintenance of Delayed Implantation in the Mustelidae (Mammalia: Carnivora) (англ.) // Evolution. — Jan., 2004. — Т. 58, № 1. — P. 175—183. Архивировано 14 августа 2011 года.
- ↑ 1 2 3 М. B. Renfree, G. Shaw. Diapause (англ.) // Annual Review of Physiology. — Mar., 2000. — Т. 62. — P. 353—375.
- ↑ 1 2 3 4 5 Julian Lombardi. Comparative vertebrate reproduction (неопр.). — Springer, 1998. — P. 249. — ISBN 0792383362, 9780792383369.
- ↑ 1 2 3 Victor R. Alekseev, Jiang-Shiou Hwang, and Mei-Hui Tseng. Diapause in Aquatic Invertebrates: What's Known and What's Next in Research and Medical Application? (англ.) // Journal of Marine Science and Technology. — 2006. — Т. 14, № 4. — P. 269—286. (недоступная ссылка)
- ↑ 1 2 3 G. Feldhamer, L. Drickamer, S. Vesery. Mammalogy: adaptation, diversity, ecology, 3rd edition (неопр.). — The Johns Hopkins University Press, 2007. — P. 220. — ISBN 0801886953.
- ↑ 1 2 R. J. Aitken. Embryonic diapause (англ.) // Development in mammals. — 1977. — Т. 1. — P. 307-308.
- ↑ 1 2 3 Hermes, Robert. Sonographie der Trächtigkeit beim Europäischen Reh (Capreolus capreolus) und Quantifizierung endometrialer Veränderungen während der Diapause mittels computergestützter Graustufenanalyse (неопр.). — J. — Berlin: Diss. med.vet. FU-Berlin, 1997. Архивировано 6 марта 2016 года.
- ↑ 1 2 В. А. Заславский. Фотопериодический и температурный контроль развития насекомых. — Л.: Наука Ленингр. отд-ние, 1984.
- ↑ A. D. Lees. the physiology of diapause in arthropods (неопр.). — Cambrige: University Press, 1955.
- ↑ 1 2 3 4 David Stanley Saunders. Insects clocks (неопр.). — Oxford - New York: Pergamon Press, 1982. — P. 284.
- ↑ 1 2 3 D. R. Khanna. Biology of Arthropoda (неопр.). — New Delhi, India: Discovery Publishing House, 2004. — P. 291-315. — ISBN 817141897X, 9788171418978.
- ↑ 1 2 Kinsaku Hasegawa. The Diapause Hormone of the Silkworm, Bombyx mori (англ.) // Nature. — 22 Jun., 1957. — Вып. 179. — P. 1300—1301. Архивировано 4 декабря 2016 года.
- ↑ Toshio Ichikawa, Satoshi Kamimoto. Firing Activities of Neurosecretory Cells Producing Diapause Hormone and its Related Peptides in the Female Silkmoth, Bombyx mori. II. Mandibular and Maxillary Cells (англ.) // Zoological Science. — 2003. — Вып. 20. — P. 979—983.
- ↑ 1 2 3 H. Frederik Nijhout. Insect Hormones (неопр.). — Princeton University Press, 1998. — P. 166. — ISBN 0691059128, 9780691059129.
- ↑ 1 2 Julie A. Reynolds, Steven C. Hand. Embryonic diapause highlighted by differential expression of mRNAs for ecdysteroidogenesis, transcription and lipid sparing in the cricket Allonemobius socius (англ.) // The Journal of Experimental Biology. — 12 June 2009. — Вып. 212(13). — P. 2075-2084. — doi:10.1242/jeb.027367. Архивировано 10 января 2022 года.
- ↑ Tyndale-Biscoe, C. H. The role of the corpus luteum in the delayed implantation of marsupials (англ.) // Delayed Implantation / Enders, А. С. — University of Chicago Press, 1963. — P. 15—28.
- ↑ 1 2 Patricia J. Berger. Eleven-month «Embryonic Diapause» Marsupial (англ.) // Nature. — 23 Jul., 1966. — Вып. 211. — P. 435—436. Архивировано 3 октября 2012 года.
- ↑ Carolyn M. King. The origin and adaptive advantages of delayed implantation in Mustela erminea (англ.) // Oikos 42. — 1984. — Вып. 20. — P. 126—128. Архивировано 24 мая 2010 года.
- ↑ М. Г. Николаева, М. В. Разумова, В. Н. Гладкова. Справочник по проращиванию покоящихся семян. — Л.: Изд-во «Наука», 1985. Архивировано 26 апреля 2010 года.
- ↑ 1 2 Michael Fenner, Ken Thompson. The Ecology of Seeds (неопр.). — Chicago Natural History Museum, 2005. — P. 97.
- ↑ Chicago Natural History Museum Bulletin (неопр.). — Springer, 1953.
- ↑ 1 2 Takashi Homma, Ken Watanabe, Shuichiro Tsurumaru, Hiroshi Kataoka, Kunio Imai, Mari Kamba, Teruyuki Niimi, Okitsugu Yamashita and Toshinobu Yaginuma. G protein-coupled receptor for diapause hormone, an inducer of Bombyx embryonic diapause (англ.) // Biochemical and Biophysical Research Communications. — San Diego, CA, USA: Elsevier, May 26, 2006. — Т. 344, вып. 1. — ISSN 0006-291X.
- ↑ Richard W. Hill, Gordon A. Wyse, and Margaret Anderson. Animal Physiology, Second Edition (неопр.). — Sinauer Associates, Inc, April 4, 2008. — ISBN 978-0-87893-317-4. (недоступная ссылка)
- ↑ Julie Annette Reynolds. [http://etd.lsu.edu/docs/available/etd-10262007-115116/unrestricted/Dissertation%5Bfinal%5D.pdf Animal Metabolism and Gene Expression During Embryonic Diapause in Arthropods (A Dissertaion)] (неопр.). — December 2007. Архивировано 2 июля 2010 года. Архивированная копия. Дата обращения: 27 декабря 2010. Архивировано 2 июля 2010 года..
- ↑ 1 2 3 R. F. Chapman. The Insects: Structure and Function, 4th Edition (неопр.). — Cambridge University Press, 1998. — ISBN 0521578906.
- ↑ Схема нейроэндокринного контроля метаморфоза (недоступная ссылка) на сайте «Эмбриология животных», 18.10.2009
- ↑ Kunio Imai, Takamichi Konno, Yoshitaka Nakazawa, Takashi Komiya, Minoru Isobe, Kazushi Koga, Toshio Goto, Toshinobu Yaginuma, Kiyoshi Sakakibara, Kinsaku Hasegawa, Okitsugu Yamashita. Isolation and Structure of Diapause Hormone of the Silkworm, Bombyx mori (англ.) // Proceedings of the Japan Academy. Ser. B: Physical and Biological Sciences. — 1991. — Т. 67, № 6. — P. 98-101. — ISSN 0386-2208. — doi:10.2183/pjab.67.98. (недоступная ссылка)
- ↑ Robert A. Browne, Patrick Sorgeloos, Clive N. A. Trotman. Artemia biology (неопр.). — CRC Press, 1991. — P. 94-118. — 374 p. — ISBN 0849367298, 9780849367298.
- ↑ Menze M. A., Fortner G., Nag S., and Hand S. C. Mechanisms of apoptosis in Crustacea: what conditions induce versus suppress cell death? (англ.) // Apoptosis. — 2010. — Т. Mar;15(3). — P. 293-312. Архивировано 9 апреля 2012 года.
- ↑ Vadim E. Panov, Piotr I. Krylov, and Nicoletta Riccardi. Role of diapause in dispersal and invasion success by aquatic invertebrates (англ.) // Journal of Limnology. — 2004. — Т. 63 (Suppl. 1). — P. 56—69. (недоступная ссылка)
- ↑ 1 2 William Duguid. Laboratory study of reproduction and development of Lopholithodes foraminatus (brown box crab), with a discussion of reversed asymmetry. — University of Victoria, 2002.
- ↑ 1 2 3 4 5 Robert G. Wear. Incubation in British Decapod Crustacea, and the Effects of Temperature on the Rate and Success of Embryonic Development (англ.) // Journal of the Marine Biological Association of the United Kingdom. — 1974. — Vol. 54. — P. 745-762.
- ↑ David T. Booth. The Breaking of Diapause in Embryonic Broad-Shell River Turtles (Chelodina expansa) (англ.) // Journal of Herpetology. — Society for the Study of Amphibians and Reptiles. — Т. 36, № 2.
- ↑ 1 2 Rodney A. Mead. Embryonic diapause in vertebrates (англ.). — 1993. — Т. 266, № 6. — P. 629—641. (недоступная ссылка)
- ↑ Arnab Banerjee, K. J. Meenakumari, S. Udin and A. Krishna. Melatonin regulates delayed embryonic development in the short-nosed fruit bat, Cynopterus sphinx (англ.) // Reproduction. — 2009. — Вып. 138. — P. 935—944. (недоступная ссылка)
- ↑ C. Hugh Tyndale-Biscoe. Life of marsupials (неопр.). — Victoria, Australia: CSIRO Publishing, 2005. — 442 p. — ISBN 0-643-06257-2.
- ↑ Marilyn B. Renfree, D. W. Lincoln, O. F. X. Almeida, R. V. Short. Abolition of seasonal embryonic diapause in a wallaby by pineal denervation (англ.) // Nature. — 10 Sep., 1981. — Вып. 293. — P. 138—139.
- ↑ И. Н. Вагина, С. В. Евсиков, А. П. Соломко. Генетический контроль раннего эмбриогенеза // Біополімери і клітина. — 2003. — Т. 19, № 1. — ISSN 0233-7657. Архивировано 4 марта 2016 года.
- ↑ Б. П. Токин. Общая эмбриология: Учеб. для биол. спец. ун-тов. — 4-е изд., перераб. и доп. — М.: Высшая школа, 1987.
- ↑ 1 2 3 Jørgen Grinsted, Birthe Avery. A sporadic case of delayed implantation after in-vitro fertilization in the human? (англ.) // Human Reproduction. — 1996. — Т. 11, № 3. — P. 651–654.
- ↑ 1 2 Juan J. Tarín, Antonio Cano. Do human concepti have the potential to enter into diapause? (англ.) // Human Reproduction. — 1999. — Т. 14, № 10. — P. 2434–2436.
- ↑ James Olcese. Melatonin after four decades: an assessment of its potential; 1 edition (неопр.). — Springer, 2000. — P. 206. — 488 p. — ISBN 030646134X, 978-0306461347.
- ↑ 1 2 3 4 Ernst Knobil, Jimmy D. Neill. Knobil and Neill’s physiology of reproduction (неопр.). — Elsevier Academic Press, 2006. — P. 154.
Литература
править- John C. Avise. Evolutionary Pathways in Nature: A Phylogenetic Approach (неопр.). — Cambridge University Press 2006. — P. 110-113. — 298 p. — ISBN 0521674174.
- Flavia L. Lopes, Joëlle A. Desmarais and Bruce D. Murphy. Embryonic diapause and its regulation (англ.) // Reproduction. — 2004. — Вып. 128. — P. 669—678. Архивировано 6 сентября 2008 года.
Ссылки
править- http://www.diapausefoundation.org - The Diapause Research Foundation, некоммерческая организация, занимающаяся изучением механизмов диапаузы и поддержкой других квалифицированных учёных, работающих в этой области.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |