Цистеиновые протеазы
Цистеиновые протеазы, также известные, как цистеиновые эндопептидазы или тиоловые протеазы (КФ 3.4.22) — группа протеолитических ферментов (эндопептидаз), расщепляющих белковые молекулы, на составляющие их аминокислоты, посредством гидролиза пептидной связи (протеолиза). В состав активного центра данных протеаз обязательно входит цистеин и их каталитическая активность зависит от сульфгидрильной или тиоловой группы (-SH-группа).
| Цистеиновая пептидаза | |
|---|---|
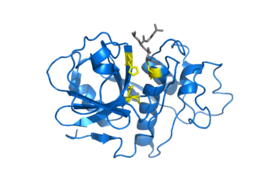 ] ]Кристаллическая структура цистеиновой протеазы — папаина, в комплексе вместе со связанным ингибитором E-64. Предоставлено из PDB 1PE6 | |
| Идентификаторы | |
| Символ | Peptidase_C1 |
| Pfam | PF00112 |
| Pfam clan | CL0125 |
| InterPro | IPR000668 |
| SMART | SM00645 |
| PROSITE | PDOC00126 |
| MEROPS | C1 |
| SCOP | 1aec |
| SUPERFAMILY | 1aec |
| OPM superfamily | 420 |
| OPM protein | 1m6d |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Цистеиновые протеазы обычно встречаются во фруктах, включая папайю, ананас, инжир и киви. Доля протеазы во фруктах зависит от зрелости, чем больше зрелость, тем меньше их содержится в плоде. Известно, что десятки латексов из различных семейств растений содержат цистеиновые протеазы[1]. Тиоловые протеазы используются в качестве основного компонента в мясных тендерайзерах (размягчителях).
Классификация
правитьСистема классификации протеаз MEROPS насчитывает 14 суперсемейств плюс несколько необозначенных семейств (с 2013 года), каждая из которых содержит большое количество семейств. Каждое надсемейство использует каталитическую триаду или диаду в разных белковых фолдах, и, таким образом, представляют собой конвергентную эволюцию каталитического механизма.
Для суперсемейств, P = суперсемейство, которое состоит из смесь семейств класса нуклеофилов, C = суперсемейство чисто цистеиновых протеаз. Внутри каждого суперсемейства, входящие в них семейства обозначаются каталитическим нуклеофилом (C = цистеинпротеазы).
В таблице указаны все суперсемейства цистеиновых протеаз:
| Суперсемейство | Семейство | Примеры |
|---|---|---|
| CA | C1, C2, C6, C10, C12, C16, C19, C28, C31, C32, C33, C39, C47, C51, C54, C58, C64,
C65, C66, C67, C70, C71, C76, C78, C83, C85, C86, C87, C93, C96, C98, C101 |
Папаин (Carica papaya)[2], бромелаин (Ananas comosus), катепсин K (печёночники)[3] и кальпаин (Homo sapiens)[4] |
| CD | C11, C13, C14, C25, C50, C80, C84 | Каспаза 1 (Rattus norvegicus) и сепараза (Saccharomyces cerevisiae) |
| CE | C5, C48, C55, C57, C63, C79 | Аденаин (аденовирус человека тип 2) |
| CF | C15 | Pyroglutamyl-peptidase I (Bacillus amyloliquefaciens) |
| CL | C60, C82 | Сортаза A (Staphylococcus aureus) |
| CM | C18 | Пептидаза-2 вируса гепатита C (вирус гепатита C) |
| CN | C9 | Sindbis virus-type nsP2 peptidase (sindbis virus) |
| CO | C40 | Dipeptidyl-peptidase VI (Lysinibacillus sphaericus) |
| CP | C97 | DeSI-1 пептидаза (Mus musculus) |
| PA | C3, C4, C24, C30, C37, C62, C74, C99 | TEV-протеазы (Вирус гравировки табака) |
| PB | C44, C45, C59, C69, C89, C95 | Предшественник амидофосфорибозилтрансферазы (Homo sapiens) |
| PC | C26, C56 | Gamma-glutamyl hydrolase (Rattus norvegicus) |
| PD | C46 | Hedgehog protein (Drosophila melanogaster) |
| PE | P1 | DmpA aminopeptidase (Ochrobactrum anthropi) |
| Необозначенные | C7, C8, C21, C23, C27, C36, C42, C53, C75 |
Механизм катализа
правитьПервым шагом в механизме реакции, посредством которого цистеиновые протеазы катализируют гидролиз пептидных связей, является депротонизация тиола в активном центре фермента смежной аминокислотой с основной боковой цепью, обычно гистидиновым остатком. Следующим шагом является нуклеофильная атака анионной серы депротонированного цистеина на карбонильном атоме углерода основания. На этой стадии фрагмент субстрата высвобождается с аминовым концом, остаток гистидина в протеазе восстанавливается до депротонированной формы и образуется тиоэфирное промежуточное соединение, связывающее новый карбокси-конец субстрата с цистеиновым тиолом. Поэтому их также иногда называют тиол-протеазами. Затем тиоэфирную связь гидролизуют с образованием фрагмента карбоновой кислоты на оставшемся фрагменте субстрата при регенерации свободного фермента.
Регуляция
правитьПротеазы обычно синтезируются в виде больших белков-предшественников, называемых зимогенами, примером служат предшественники сериновых протеаз трипсиноген и химотрипсиноген и пепсиноген, предшественник аспарагиновой протеазы. Протеаза активируется удалением ингибирующего сегмента или белка. Активация происходит, когда протеаза доставляется в конкретный внутриклеточный компартмент (например, в лизосому) или во внеклеточную среду (например, в просвет желудка). Данная система предотвращает повреждения клеток, которые продуцируют протеазу.
Ингибиторы протеаз обычно представляют собой белки с доменами, которые интернируют или блокируют активный сайт протеазы для предотвращения доступа к субстрату. При конкурентном ингибировании ингибитор связывается с активным центром, тем самым предотвращая взаимодействие фермента с субстратом. При неконкурентном ингибировании ингибитор связывается с аллостерическим сайтом, который изменяет конформацию активного сайта и, тем самым делает его недоступным для субстрата.
Примеры ингибиторов протеаз:
- Серпины
- Стефины
- Ингибиторы апоптоза.
Биологическая значимость
правитьЦистеиновые протеазы играют многогранную роль, практически во всех аспектах физиологии и развития. В растениях они важны для роста и развития, а также для накопления и мобилизации белков хранения, таких как семена. Кроме того, они участвуют в сигнальных путях и в ответ на биотические и абиотические стрессы[5]. У людей и других животных они ответственны за старение и апоптоз (запрограммированную гибель клеток), иммунные ответы белков MHC класса II, прогормональный процессинг и ремоделирование внеклеточного матрикса, важные для развития костей. Способность макрофагов и других клеток мобилизовывать эластолитические цистеиновые протеазы на их поверхности в специализированных условиях может также приводить к ускоренной деградации коллагена и эластина в местах воспаления при таких заболеваниях, как атеросклероз и эмфизема[6]. Несколько вирусов (например, полиомиелита, гепатита С) экспрессируют весь свой геном в виде простого массивного полипептида и используют протеазу для расщепления его на функциональные единицы (например, протеазу вируса гравировки табака).
Применение
правитьВ качестве потенциальных фармацевтических препаратов
правитьВ настоящее время широко распространено использование цистеиновых протеаз в качестве одобренных и эффективных противогельминтных препаратов. Было обнаружено, что цистеиновые протеазы растений, выделенные из них, обладают высокой протеолитической активностью, которые, как известно, расщепляют (гидролизуют) кутикулу нематод и обладает очень низкой токсичностью[7]. Сообщалось об успешных результатах использования цистеиновых протеаз против нематод, таких как Heligmosomoides bakeri, Trichinella spiralis, Nippostrongylus brasiliensis, Trichuris muris и Ancylostoma ceylanicum; цепней — Rodentolepis microstoma, а также свиного скребня — паразита Macracanthorynchus hirundinaceus[8]. Полезным свойством цистеиновых протеаз является устойчивость к кислой среде желудка, что позволяет осуществлять их пероральное введение. Они представляют собой альтернативный механизм действия современным антигельминтикам, и развитие резистентности считается маловероятным, поскольку это потребует полного изменения структуры кутикулы гельминта.
Другое
правитьЦистеиновые протеазы используются в качестве кормовых добавок для скота в качестве улучшителей усваиваемости белков и нуклеиновых кислот[9].
Примечания
править- ↑ Domsalla A., Melzig M. F. Occurrence and properties of proteases in plant latices. (англ.) // Planta medica. — 2008. — Vol. 74, no. 7. — P. 699—711. — doi:10.1055/s-2008-1074530. — PMID 18496785.
- ↑ Mitchel R. E., Chaiken I. M., Smith E. L. The complete amino acid sequence of papain. Additions and corrections. (англ.) // The Journal of biological chemistry. — 1970. — Vol. 245, no. 14. — P. 3485—3492. — PMID 5470818.
- ↑ Sierocka I., Kozlowski L. P., Bujnicki J. M., Jarmolowski A., Szweykowska-Kulinska Z. Female-specific gene expression in dioecious liverwort Pellia endiviifolia is developmentally regulated and connected to archegonia production. (англ.) // BMC plant biology. — 2014. — Vol. 14. — P. 168. — doi:10.1186/1471-2229-14-168. — PMID 24939387.
- ↑ Sorimachi H., Ohmi S., Emori Y., Kawasaki H., Saido T. C., Ohno S., Minami Y., Suzuki K. A novel member of the calcium-dependent cysteine protease family. (англ.) // Biological chemistry Hoppe-Seyler. — 1990. — Vol. 371 Suppl. — P. 171—176. — PMID 2400579.
- ↑ Grudkowska M., Zagdańska B. Multifunctional role of plant cysteine proteinases (неопр.) // Acta Biochim. Pol.. — 2004. — Т. 51, № 3. — С. 609—624. — PMID 15448724. Архивировано 24 октября 2018 года.
- ↑ Chapman H.A., Riese R.J., Shi G.P. Emerging roles for cysteine proteases in human biology (англ.) // Annual Reviews : journal. — 1997. — Vol. 59. — P. 63—88. — doi:10.1146/annurev.physiol.59.1.63. — PMID 9074757.
- ↑ Stepek G., Behnke J.M., Buttle D.J., Duce I.R. Natural plant cysteine proteinases as anthelmintics? (англ.) // Trends[англ.] : journal. — 2004. — July (vol. 20, no. 7). — P. 322—327. — doi:10.1016/j.pt.2004.05.003. — PMID 15193563.
- ↑ Behnke J.M., Buttle D.J., Stepek G., Lowe A., Duce I.R. Developing novel anthelmintics from plant cysteine proteinases (англ.) // Parasites & Vectors[англ.] : journal. — 2008. — Vol. 1, no. 1. — P. 29. — doi:10.1186/1756-3305-1-29. — PMID 18761736. — PMC 2559997.
- ↑ O'Keefe, Terrence Protease enzymes improve amino acid digestibility. Wattagnet (6 апреля 2012). Дата обращения: 6 января 2018. Архивировано 23 сентября 2018 года.