Хлорэтан
Хлорэта́н (хлорэтил, этилхлорид, хлористый этил, лат. Aethylii chloridum) — хлорорганическое вещество, однозамещённый галогеналкан с формулой C2H5Cl. Бесцветный легкосжижаемый газ со слабым характерным запахом, огнеопасен. Применяется в медицине для анестезии методом сильного охлаждения, ранее иногда использовался для ингаляционного наркоза, и применяется в рекреационных целях, наподобие попперс и закиси азота.
| Хлорэтан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Хлорэтан |
| Традиционные названия | монохлорэтан, этилхлорид, хлористый этил |
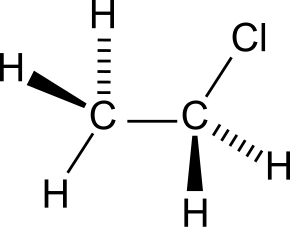
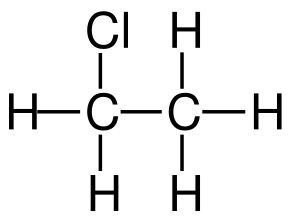
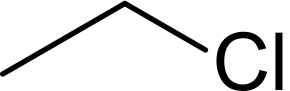
| Хим. формула | C2H5Cl |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 64,51 г/моль |
| Плотность | 0,8898 г/см³ |
| Энергия ионизации | 10,97 ± 0,01 эВ[1][2] |
| Термические свойства | |
| Температура | |
| • плавления | −138,7 °C |
| • кипения | 12,27 °C |
| • вспышки | −58 ± 1 ℉[1] |
| Пределы взрываемости | 3,8 ± 0,1 об.%[1] |
| Давление пара | 1000 ± 1 мм рт.ст.[1] |
| Структура | |
| Дипольный момент | 6,8E−30 Кл·м[2] |
| Классификация | |
| Рег. номер CAS | 75-00-3 |
| PubChem | 6337 |
| Рег. номер EINECS | 200-830-5 |
| SMILES | |
| InChI | |
| RTECS | KH7525000 |
| ChEBI | 47554 |
| ChemSpider | 6097 |
| Безопасность | |
| Токсичность | ядовит, огнеопасен, канцероген |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Хлорэтан | |
|---|---|
 | |
 | |
 | |
| Химическое соединение | |
| Брутто-формула | C2H5Cl |
| CAS | 75-00-3 |
| PubChem | 6337 |
| DrugBank | DB13259 |
| Состав | |
| Классификация | |
| АТХ | N01BX01 |
| Другие названия | |
| хлористый этил, этилхлорид | |
Впервые был получен алхимиком Василием Валентином в 1440 году в реакции этилового спирта и соляной кислоты[3]
Также известен как хладагент R-160.
Синонимы
правитьЭтилхлорид, Aether chloratus, Aethylis chloridum, Aethylium chloratum, Chelen, Chlorene, Chloretan, Ethylis chloridum, Ethyl chloride, Kelen, Хлористый этил, хлорэтан.
Общая информация
правитьХлорэтил является мощным наркотическим средством. При концентрации хлорэтила во вдыхаемой смеси 3—4 об. % наступает хирургическая стадия наркоза. Наркоз развивается быстро, в течение 2—3 мин, стадия возбуждения непродолжительна. Пробуждение наступает быстро.
Основной недостаток хлорэтила — малая терапевтическая широта и в связи с этим опасность передозировки.
В настоящее время хлорэтил применяют для наркоза редко (лишь при очень кратковременных оперативных вмешательствах), в основном он используется как местное средство для кратковременного поверхностного обезболивания кожных покровов.
При попадании на кожу он вызывает вследствие быстрого испарения сильное охлаждение кожи, ишемию и понижение чувствительности, что позволяет пользоваться им при небольших поверхностных операциях (разрезы кожи).
Кроме того, хлорэтилом пользуются для уменьшения кожного зуда, а также для лечения (криотерапия) рожистого воспаления, нейромиозитов, невралгий, термических ожогов, бородавчатой формы красного лишая, очаговой алопеции. Для этих целей с бокового капилляра ампулы с хлорэтилом снимают резиновый колпачок, согревают ампулу в ладони и выделяющуюся струю направляют на поверхность кожи (с расстояния 25—30 см). После появления на коже «инея» ткани становятся плотными и нечувствительными. В лечебных целях процедуры производят раз в день в течение 7—10 дней.
Применять хлорэтил следует с осторожностью: возможны гиперемия и повреждение целостности кожи с экссудацией.
Противопоказания
правитьПротивопоказаниями к применению являются нарушения целостности кожных покровов, заболевания сосудов (варикозное расширение вен, сосудистые спазмы). Больные не должны вдыхать хлорэтил, испаряющийся с поверхности кожи.
Физические свойства
правитьПрозрачная, бесцветная, легко летучая жидкость своеобразного запаха. Трудно растворим в воде (приблизительно 1:50). Смешивается во всех соотношениях со спиртом и эфиром. Огнеопасен. Горит, окрашивая пламя в зелёный цвет. Плотность 0,919—0,923 (при 0 °C). Температура кипения +12—13°С.
Форма выпуска
править- в ампулах по 30 мл в упаковке по 10 штук.
Хранение
правитьВ прохладном, защищённом от света месте.
Примечания
править- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0267.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Rossberg M. et al. Chlorinated Hydrocarbons // Ullmann's Encyclopedia of Industrial Chemistry[англ.] (англ.). — Weinheim: Wiley-VCH, 2006. — doi:10.1002/14356007.a06_233.pub2.
Литература
править- Сум Н., Менделеев Д. И. Этил хлористый // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Это заготовка статьи по фармакологии. Помогите Википедии, дополнив её. |
