Ферментативная кинетика
Ферментати́вная кине́тика — зависимость скорости химической реакции от её условий[1] — раздел биохимии, предметом которого являются химические реакции, катализируемые ферментами, изучающий закономерности течения во времени и механизм ферментативных реакций[2]. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагентов (субстратов, ферментов), количественным изучением эффектов варьирования условий (кинетики) той или иной химической реакции (концентрация, pH среды, температура, присутствие активаторов или ингибиторов), а также измеряет её скорость[3]. Изучение ферментов позволяет выявить каталитический механизм действия определённого фермента и контролировать его роль в процессе обмена веществ, способного замедлять (ингибировать) или ускорять (активировать) ход химической реакции. Таким образом, кинетические исследования позволяют не только определить сродство и специфичность связывания субстратов и ингибиторов к ферментам, но и найти максимальную скорость процесса, катализируемого специфическим ферментом, а также попутно решить многие другие задачи и возникающие проблемы. При этом, основная часть проблем ферментативной кинетики сводится к[4]:
- анализу предполагаемых схем ферментативных реакций,
- выводу уравнений скорости, соответствующих этим схемам,
- сопоставлению полученных зависимостей с данными эксперимента.
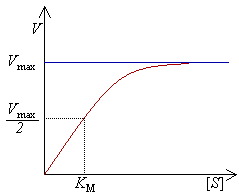
Одним из характерных проявлений жизни на Земле является уникальная способность живых организмов кинетически регулировать течение химических реакций, тем самым подавляя стремление к достижению термодинамического равновесия. Основная цель изучения кинетики ферментативных реакций — получение информации, способствующей выяснению молекулярного механизма действия фермента.
Ферменты представляют собой белковые молекулы, которые управляют скоростью химической реакции между молекулами других веществ (субстратами ферментов). Ферментативный механизм в ходе детального исследования представляет собой серию шагов превращения молекул активного субстрата, связанного с ферментом, в конечные продукты химической реакции. Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду. При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, тогда как небелковые катализаторы только в сотни и тысячи раз.
См. также
правитьПримечания
править- ↑ Метаболизм. Ферменты: Кинетика ферментативных реакций. chem.msu.su. Дата обращения: 25 октября 2014. Архивировано 23 сентября 2015 года.
- ↑ Под ред. И. Л. Кнунянца. Ферментативных реакций кинетика // Химическая энциклопедия. — М.: Советская энциклопедия. — 1988.
- ↑ [www.xumuk.ru/biologhim/049.html Химик.ру:] Кинетика ферментативных реакций. xumuk.ru. Дата обращения: 25 октября 2014.
- ↑ Березин И. В, Клёсов А. А. Практический курс химической и ферментативной кинетики. — М.: Наука (Изд-во МГУ), 1974. — 324 с. Архивировано 25 октября 2014 года.
В другом языковом разделе есть более полная статья Enzymkinetik (нем.). |
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |