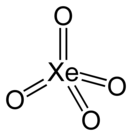
Тетраоксид ксенона
Тетраокси́д ксено́на XeO4 — жёлтые кристаллы при температуре ниже −36 °C. XeO4 — соединение ксенона, в котором ксенон проявляет высшую степень окисления +8 (такую степень окисления ксенон может проявить только в соединении с кислородом, максимальная степень окисления со фтором равна +6, например, в гексафториде ксенона) и соответственно валентность, равную 8. Кроме него такую же степень окисления ксенон имеет в ксеноновой кислоте и её солях.
| Тетраоксид ксенона | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
тетраоксид ксенона | ||
| Хим. формула | XeO4 | ||
| Физические свойства | |||
| Молярная масса | 195,29 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −35,9 °C | ||
| • кипения | взрывается ок. 0[1] °C | ||
| Классификация | |||
| Рег. номер CAS | 12340-14-6 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 21106492 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Свойства
правитьВ сухом виде тетраоксид ксенона чрезвычайно взрывоопасен. Водный раствор является кислотой и не взрывоопасен; является сильным окислителем. Реагируя с водой и растворами щелочей, образует ксеноновую кислоту H4XeO6 и её соли — перксенаты.
Неустойчивое соединение, сохраняется только при температуре ниже −196 °C. При температуре выше −35,9 °C спонтанно взрывается, превращаясь в ксенон и кислород.
Тетраоксид ксенона — один из сильнейших известных науке окислителей. В частности, он намного более сильный, чем триоксид ксенона. Однако он крайне неустойчив, поэтому сложен в применении.
Получение
правитьПолучают реакцией перксенатов с серной кислотой при охлаждении.
Примечания
править- ↑ Lide, David R. Handbook of Chemistry and Physics. — Boca Raton, FL: CRC Press, 1998. — 494 с. — ISBN 0-8493-0594-2.