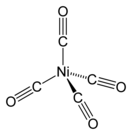
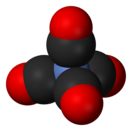
Тетракарбонилникель — неорганическое соединение, карбонильный комплекс никеля состава Ni(CO)4, бесцветная ядовитая жидкость, не смешивается с водой, в смеси с воздухом самовоспламеняется и взрывается.
| Тетракарбонилникель | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Тетракарбонилникель | ||
| Традиционные названия | Тетракарбонил никеля | ||
| Хим. формула | Ni(CO)4 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 170,73 г/моль | ||
| Плотность | 1,78-55; 1,3560; 1,3220 г/см³ | ||
| Энергия ионизации | 8,28 ± 0,01 эВ[1] и 8,27 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -25; -23; -19,3; -17,2 °C | ||
| • кипения | 42,2; 42,3; 43 °C | ||
| • вспышки | −4 ± 1 ℉[1] | ||
| Пределы взрываемости | 2 ± 1 об.%[1] | ||
| Давление пара | 315 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,01810 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 13463-39-3 | ||
| PubChem | 26039 | ||
| Рег. номер EINECS | 236-669-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | QR6300000 | ||
| ChEBI | CHEBI:30372 | ||
| Номер ООН | 1259 | ||
| ChemSpider | 24253 | ||
| Безопасность | |||
| Предельная концентрация | 0,0005 мг/м³ | ||
| Токсичность | СДЯВ, чрезвычайно токсичен, особенно опасны его пары, канцероген, мутаген, аллерген | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
править- Действие монооксида углерода под давлением на порошок никеля:
- Действие монооксида углерода на хлорид гексаамминникеля(II)
- Разложение кислотами никелевых комплексов, содержащих CO:
Физические свойства
правитьТетракарбонилникель образует зеленую диамагнитную жидкость, не растворяется в холодной воде, растворяется в диэтиловом эфире, хлороформе, бензоле, толуоле.
В смеси с воздухом при концентрации выше 4% самовоспламеняется и взрывается.
Химические свойства
править- Разлагается при нагревании:
- Реагирует с концентрированными кислотами:
- Во влажных условиях медленно окисляется:
- Окисляется кислородом при нагревании:
Применение
править- Никелевые покрытия неметаллических поверхностей
- Для получения никеля высокой чистоты.
- В качестве катализатора.
Токсичность
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
- Тетракарбонил никеля летуч и чрезвычайно ядовит, Опасность соединения состоит не столько в содержании легко высвобождаемого монооксида углерода, сколько в токсичности самого никеля, попадающего в организм. Карбонил никеля может быть смертелен при попадании на кожу или вдыхании паров. ЛК50 при 30-минутной экспозиции достигается при 3 ppm, а концентрация, абсолютно смертельная для человека — 30 ppm. Некоторые люди, испытавшие на себе воздействие концентраций до 5 ppm, описывали его запах как «затхлый» или «копчёный», но поскольку соединение весьма токсично, то смертельное отравление может быть вызвано концентрациями паров, при которых его запах абсолютно неощутим.
- Отравление карбонилом никеля проходит в две стадии. Первая характеризуется головными болями и болью в груди, продолжающимися несколько часов, обычно прерываемыми периодом мнимого благополучия. Вторая стадия — химический пневмонит, начинающийся обычно через 16 часов после экспозиции, с кашлем, одышкой и сильнейшей слабостью. Эти симптомы нарастают в течение четырёх дней, при отсутствии медицинской помощи как правило заканчиваясь смертью от сердечно-легочной или почечной недостаточности. Выздоровление часто чрезвычайно длительное, сопровождающееся сильной усталостью, депрессией и одышкой при физических нагрузках. Хроническое поражение органов дыхания нехарактерно. Канцерогенность тетракарбонила никеля точно не установлена и является темой для дискуссий.
Примечания
править- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0444.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.