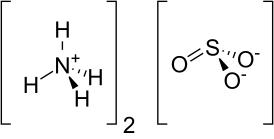
Сульфит аммония — неорганическое соединение, соль аммония и сернистой кислоты с формулой (NH4)2SO3, бесцветные кристаллы, растворимые в воде, образует кристаллогидрат.
| Сульфит аммония | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Сульфит аммония |
| Традиционные названия | Сернистокислый аммоний |
| Хим. формула | (NH4)2SO3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 116,14 г/моль |
| Плотность | гидр. 1,41 г/см³ |
| Термические свойства | |
| Температура | |
| • кипения | возг. 150 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 280 г/100 мл |
| Классификация | |
| Рег. номер CAS | 17026-44-7 |
| PubChem | 25041 и 16211200 |
| Рег. номер EINECS | 233-484-9 |
| SMILES | |
| InChI | |
| ChEBI | 186946 |
| ChemSpider | 23404 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
править- Крепкий водный раствор аммиака делят на две приблизительно одинаковые части. Меньшую из них при охлаждении насыщают оксидом серы (IV). Затем к полученному раствору гидросульфита прибавляют вторую часть:
Физические свойства
правитьСульфит аммония образует бесцветные кристаллы.
Хорошо растворим в воде, слабо растворим в этаноле, не растворим в ацетоне.
Образует кристаллогидрат состава (NH4)2SO3•H2O.
Химические свойства
править- Безводную соль можно получить сушкой кристаллогидрата в вакууме:
- При нагревании кристаллогидрат превращается в гидросульфит аммония:
- Медленно окисляется кислородом воздуха:
- Разлагается кислотами:
Применение
править- В косметологии.
- Восстановитель в фотографии.
Примечания
правитьЛитература
править- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
