Сульфат марганца(III)
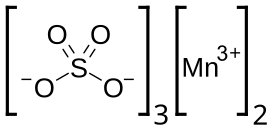
Сульфат марганца(III) — неорганическое соединение, соль металла марганца и серной кислоты с формулой Mn2(SO4)3, тёмно-зелёные кристаллы, гидролизуется водой, устойчиво в подкисленных растворах.
| Сульфат марганца(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Сульфат марганца(III) |
| Традиционные названия | сернокислый марганец |
| Хим. формула | Mn2O12S3 |
| Рац. формула | Mn2(SO4)3 |
| Физические свойства | |
| Состояние | тёмно-зелёные кристаллы |
| Молярная масса | 398,06 г/моль |
| Плотность | 3,24 г/см³ |
| Классификация | |
| Рег. номер CAS | 13444-72-9 |
| PubChem | 9930723 |
| Рег. номер EINECS | 236-586-1 |
| SMILES | |
| InChI | |
| ChemSpider | 8106354 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
править- Растворение оксида марганца(III) в холодной серной кислоте:
- Растворение оксида марганца(IV) в горячей серной кислоте:
- Растворение метагидроксида марганца в серной кислоте:
- Разложение перманганата калия в концентрированной горячей серной кислоте:
- Электролиз раствора сульфата марганца(II) в серной кислоте:
Физические свойства
правитьСульфат марганца(III) образует тёмно-зелёные гигроскопичные кристаллы, полностью гидролизуемые водой.
Устойчивы в растворах серной кислоты из которых выпадают кристаллогидраты гидросульфата марганца состава Mn2(SO4)3•H2SO4•n H2O, где n = 4, 6, 8.
Химические свойства
править- Разлагается при нагревании:
- Гидролизуется водой:
- Разлагается при кипячении в концентрированной серной кислоте:
- Окисляет концентрированную соляную кислоту:
- Реагирует с щелочами:
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |