Полисульфиды калия
Полисульфид калия — жёлто-бурые, твёрдые кристаллы с формулой K2Sn, где n=2÷6.
| Полисульфиды калия | |
|---|---|
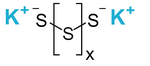 | |
| Общие | |
| Систематическое наименование |
Полисульфид калия |
| Традиционные названия | Сернистый калий |
| Хим. формула | K2Sn |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
править- Сплавлением сульфида калия с серой получается смесь полисульфидов:
- результат можно контролировать количеством серы и температурой реакции. Также эту реакцию можно проводить в подщелочённом кипящем водном растворе.
Физические свойства
правитьПолисульфиды калия — это твёрдые вещества цвета от жёлтого до жёлто-оранжевого. Хорошо растворяются в воде, высшие полисульфиды растворяются в этаноле.
| Полисульфид | Молярная масса | Плотность | Температура плавления (°С) |
Внешний вид | Кристаллогидрат |
|---|---|---|---|---|---|
| K2S2 | 142,33 | 1,973 | 520; 470; 477 | красновато-жёлтый | K2S2•3H2O |
| K2S3 | 174,39 | 2,102 | 292; 252; 295 | жёлто-коричневый | |
| K2S4 | 206,46 | 159; 145 | красно-коричневый | K2S4•2H2O | |
| K2S5 | 238,53 | 2,128 | 211; 206; 207 | Оранжевый | K2S5•H2O |
| K2S6 | 270,59 | 2,02 | 196; 197 |
Химические свойства
править- При сильном нагревании разлагаются с выделением серы:
- При комнатной температуре разлагаются разбавленными кислотами с выделением серы:
- При низкой температуре и концентрированной кислоте удаётся получить полисульфаны:
- Во влажной среде и на свету полисульфиды калия окисляются кислородом воздуха:
- Без воды реакция окисления идёт иначе:
Применение
править- Для сульфидирования стальных и чугунных изделий.
- Для лечения кожных заболевания («Серная печень»).
- Как пестицид.
См. также
правитьЛитература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |