Точечная мутация — тип мутации в ДНК или РНК, при котором одно азотистое основание заменяется другим. Термин также применяется и в отношении парных замен, инсерции или делеции одного или нескольких нуклеотидов. Точечные мутации, возникающие в некодирующей ДНК, обычно никак себя не проявляют. Точечный мутант — организм, в генотипе которого произошла точечная мутация.
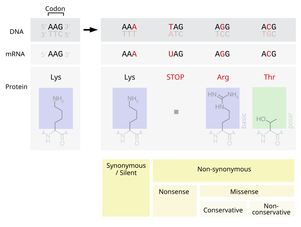
Точечные мутации классифицируют по эффекту, который изменённый нуклеотид оказывает на триплет:
- Синонимичная мутация (сайленс- или сеймсенс-мутация) — кодон продолжает кодировать ту же аминокислоту.
- Нонсенс-мутация — мутация, в результате которой кодон теряет способность кодировать какую-либо аминокислоту и становится стоп-кодоном, что приводит к преждевременной терминации синтеза белка.
- Миссенс-мутация — переключает кодон на кодирование другой аминокислоты.
Мутации замены оснований
править- Точечные мутации замены оснований делят на транзиции и трансверсии[1][2].
- Транзиция — одно пуриновое основание замещается на другое (аденин на гуанин или наоборот), либо происходит аналогичная замена пиримидиновых оснований (тимин с цитозином).
- Трансверсия — пуриновое основание замещается на пиримидиновое основание или наоборот.
Транзиции происходят чаще, чем трансверсии[3][4].
Мутации замены оснований делятся на мишенные мутации замены оснований, немишенные и задерживающиеся мутации.
Мишенные мутации замены оснований
правитьМутации замены оснований, которые появляются напротив повреждений молекулы ДНК и способны останавливать синтез ДНК, называются мишенными мутациями замены оснований (от слова «мишень») [5][6][7]. К мишенным мутациям замены оснований приводят, например, циклобутановые пиримидиновые димеры[5][6][7].
Немишенные мутации замены оснований
правитьИногда мутации замены оснований образуются на неповрежденных участках ДНК. Такие мутации называются немишенными мутациями замены оснований[8]. Механизмы образования немишенных мутаций замены оснований были разработаны в рамках полимеразной и полимеразно-таутомерной моделей мутагенеза.
Задерживающиеся мутации замены оснований
правитьМутации замены оснований не всегда образуются сразу же после воздействия мутагена. Иногда они появляются после десятков циклов репликации. Это явление носит название задерживающихся мутаций[9]. Нестабильность генома — главная причина образования злокачественных опухолей[10] — характеризуется резким возрастанием количества немишенных и задерживающихся мутаций[11]. Механизмы образования задерживающихся мутаций в настоящее время не известны.
Точечные мутации сдвига рамки чтения
правитьТочечные мутации сдвига рамки чтения гена делят на делеции и инсерции[12][13].
- Делеция — в молекуле ДНК выпадает один или несколько нуклеотидов.
- Инсерция — в молекулу ДНК встраивается один или несколько нуклеотидов.
Точечные мутации противопоставляются сложным мутациям, при которых один участок ДНК заменяется участком другой длины и иного нуклеотидного состава[14].
Точечные мутации могут появляться напротив таких повреждений молекулы ДНК, которые способны останавливать синтез ДНК. Например, напротив циклобутановых пиримидиновых димеров. Такие мутации называются мишенными мутациями (от слова «мишень»)[15]. Циклобутановые пиримидиновые димеры вызывают как мишенные мутации замены оснований, так и мишенные мутации сдвига рамки[16].
Иногда точечные мутации образуются на так называемых неповреждённых участках ДНК, часто в небольшой окрестности от фотодимеров. Такие мутации называются немишенными мутациями замены оснований или немишенными мутациями сдвига рамки[17].
Точечные мутации образуются не всегда сразу же после воздействия мутагена. Иногда они появляются после десятков циклов репликации. Это явление носит название задерживающихся мутаций[9]. При нестабильности генома, главной причине образования злокачественных опухолей, резко возрастает количество немишенных и задерживающихся мутаций[11].
Причины возникновения
правитьТочечные мутации могут возникать в результате спонтанных мутаций, происходящих во время репликации ДНК. Они также могут возникать в результате действия мутагенов — к примеру, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры или химических веществ. Мутации появляются при синтезе молекулы ДНК, содержащей повреждения, в процессах репликации ДНК, репарации ДНК или транскрипции[18][19].
В настоящее время существует несколько подходов, используемых для объяснения природы и механизмов образования точечных мутаций. В рамках общепринятой, полимеразной модели считается, что единственная причина образования мутаций замены оснований — спорадические ошибки ДНК-полимераз[20]. Уотсон и Крик[21] предложили таутомерную модель спонтанного мутагенеза. Они объяснили появление спонтанных мутаций замены оснований тем, что при соприкосновении молекулы ДНК с молекулами воды могут изменяться таутомерные состояния оснований ДНК. Образование мутаций замены оснований объяснялось образованием Хугстиновских пар[22]. Одной из причин образования мутаций замены основания считается дезаминирование 5-метилцитозина[23].
Активные формы кислорода (АФК), которые являются побочными продуктами клеточного метаболизма, могут дополнительно способствовать точечным мутациям, вызывая окислительный стресс. АФК могут привести к модификациям оснований или разрывам цепи ДНК, что приводит к мутациям, если их не исправить должным образом. [24]Со временем связи ДНК могут деградировать из-за факторов окружающей среды или естественного процесса старения, что увеличивает вероятность мутаций. Старение также может влиять на эффективность механизмов репликации и восстановления ДНК, что приводит к более высокой частоте точковых мутаций, поскольку клетки со временем накапливают повреждения[25][26][27].
Примечания
править- ↑ Тарасов В. А. Молекулярные механизмы репарации и мутагенеза. — М.: Наука, 1982. — 226 с.
- ↑ Friedberg E. C., Walker G. C., Siede W. DNA repair and mutagenesis. — Washington: ASM Press, DC, 1995.
- ↑ Fields Virology by David M Knipe and Peter M Howley | Publisher: Lippincott Williams & Wilkins, 2007 | ISBN 0-7817-1832-5 | стр. 394
- ↑ https://www.mun.ca/biology/scarr/Transitions_vs_Transversions.html Архивная копия от 22 октября 2018 на Wayback Machine Transition versus Transversion mutations
- ↑ 1 2 Wang C.-I., Taylor J.-S. In vitro evidence that UV-induced frameshift and substitution mutations at T tracts are the result of misalignment-mediated replication past a specific thymine dimer // Biochemistry - 1992. – 31. – P. 3671–3681. doi:10.1021/bi00129a016
- ↑ 1 2 Lawrence C. W., Banerjee S. K., Borden A., LeClerc J. E. T-T cyclobutane dimers are misinstructive rather than non-instructive, mutagenic lesions // Mol. Gen. Genet. – 1990. – 222. – P. 166-169. doi:10.1007/BF00283040
- ↑ 1 2 LeClerc J. E., Borden A., Lawrence C. W. The thymine-thymine pyrimidine-pyrimidine (6-4) ultraviolet light photoproduct is highly mutagenic and specifically induces 3'-thymine-to-cytosine transitions in Escherichia coli // Proc. Nat. Acad. Sci. USA. – 1991. – 88. – P. 9685-9686.
- ↑ Maor-Shoshani A., Reuven N. B., Tomer G., Livneh Z. Highly mutagenic replication by DNA polymerase V (UmuC) provides a mechanistic basis for SOS untargeted mutagenesis // Proc. Natl. Acad. Sci. USA - 2000. - 97. – P. 565–570.
- ↑ 1 2 Little J. B., Gorgojo L., Vetrovs H. Delayed appearance of lethal and specific gene mutations in irradiated mammalian cells // Int. J. Radiat. Oncol. Biol. Phys. — 1990. — 19. — P. 1425—1429.
- ↑ Кордюм В. И. Опухоль — как она видится сегодня с позиций молекулярной генетики // Биополимеры и клетка. — 2001. — Т. 17. — С. 109—139.
- ↑ 1 2 Niwa O. Radiation induced dynamic mutations and transgenerational effects // J. Radiation Research. — 2006. — 47. — P. B25-B30.
- ↑ Ауэрбах Ш. Проблемы мутагенеза. — М.: Мир, 1978. — 463 с.
- ↑ Friedberg E. C., Walker G. C., Siede W., Wood R. D., Schultz R. A., Ellenberger T. DNA repair and mutagenesis. — part 3. Washington: ASM Press. — 2006. 2nd ed.
- ↑ Levine J. G., Schaaper R. M., De Marini D. M. Complex frameshift mutations mediated by plasmid pkm 101: Mutational mechanisms deduced mutation spectra in Salmonella // Genetics. — 1994. — 136. — P. 731—746.
- ↑ Pham P., Bertram J. G, O’Donnell M., Woodgate R., Goodman M. F. A model for SOS-lesion-targeted mutations in Escherichia coli // Nature. — 2001. — 408. — P. 366—370.
- ↑ Wang C.-I., Taylor J.-S. In vitro evidence that UV-induced frameshift and substitution mutations at T tracts are the result of misalignment-mediated replication past a specific thymine dimer // Biochemistry — 1992. — 31. — P. 3671-3681.
- ↑ Maor-Shoshani A., Reuven N. B., Tomer G., Livneh Z. Highly mutagenic replication by DNA polymerase V (UmuC) provides a mechanistic basis for SOS untargeted mutagenesis // Proc. Natl. Acad. Sci. USA — 2000. — 97. — P. 565—570.
- ↑ Banerjee S. K., Borden A., Christensen R. B., LeClerc J. E., Lawrence C. W. SOS-dependent replication past a single trans-syn T-T cyclobutane dimer gives a different mutation spectrum and increased error rate compared with replication past this lesion in uniduced cell // J. Bacteriol. — 1990. — 172. — P. 2105—2112.
- ↑ Jonczyk P., Fijalkowska I., Ciesla Z. Overproduction of the subunit of DNA polymerase III counteracts the SOS-mutagenic response of Esthetician coli // Proc. Nat. Acad. Sci. USA. — 1988. — 85. — Р. 2124—2127.
- ↑ Tang M., Shen X., Frank E. G., O’Donnell M., Woodgate R., Goodman M. F. UmuD’(2)C is an error-prone DNA polymerase. Escherichia coli pol V // Proc. Natl. Acad. Sci. USA — 1999. — Vol. 96. — P. 8919-8924.
- ↑ Watson J. D., Crick F. H. C. The structure of DNA // Cold Spring Harbor Symp. Quant. Biol. — 1953. — 18. — P. 123—131.
- ↑ Полтев В. И., Шулюпина Н. В., Брусков В. И. Молекулярные механизмы правильности биосинтеза нуклеиновых кислот. Компьютерное изучение роли полимераз в образовании неправильных пар модифицированными основаниями // Молек. биол. — 1996. — 30. — С. 1284—1298.
- ↑ Cannistraro V. J., Taylor J. S. Acceleration of 5-methylcytosine deamination in cyclobutane dimers by G and its implications for UV-induced C-to-T mutation hotspots // J. Mol. Biol. — 2009. — 392. — P. 1145—1157.
- ↑ T. Yasukawa. A pathogenic point mutation reduces stability of mitochondrial mutant tRNAIle // Nucleic Acids Research. — 2000-10-01. — Т. 28, вып. 19. — С. 3779–3784. — ISSN 1362-4962. — doi:10.1093/nar/28.19.3779. Архивировано 12 сентября 2024 года.
- ↑ Joep de Ligt, Joris A Veltman, Lisenka ELM Vissers. Point mutations as a source of de novo genetic disease (англ.) // Current Opinion in Genetics & Development. — 2013-06. — Vol. 23, iss. 3. — P. 257–263. — doi:10.1016/j.gde.2013.01.007. Архивировано 10 сентября 2024 года.
- ↑ Sourav Pan. Point mutation – Definition, Causes, Types, Examples ((англ. )) : website. — 2024. Архивировано 12 сентября 2024 года.
- ↑ David N. Cooper, Michael Krawczak. The mutational spectrum of single base-pair substitutions causing human genetic disease: patterns and predictions (англ.) // Human Genetics. — 1990-06-01. — Vol. 85, iss. 1. — P. 55–74. — ISSN 1432-1203. — doi:10.1007/BF00276326. Архивировано 12 сентября 2024 года.
Ссылки
править- Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. — М.: «Мир», 1993. — Т. 2. — С. 98. — 415 с. — 12 000 экз. — ISBN 5-03-001775-5.
- MeSH Point+Mutation (англ.)