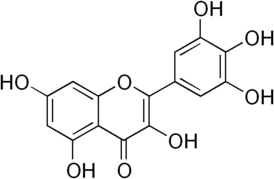
Мирицетин
Мирицетин относится к классу флавоноидов полифенольных соединений с антиоксидантными свойствами. Мирицетин может быть получен непосредственно из кемпферола[1].
| Мирицетин | |
|---|---|
 | |
| Общие | |
| Хим. формула | C15H10O8 |
| Классификация | |
| Рег. номер CAS | 529-44-2 |
| PubChem | 5281672 |
| Рег. номер EINECS | 208-463-2 |
| SMILES | |
| InChI | |
| ChEBI | CHEBI:18152 |
| ChemSpider | 4444991 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нахождение
правитьОбычные пищевые источники мирицетина: овощи (включая помидоры), фрукты (включая апельсины), орехи, ягоды, чай[2], и красное вино[3]. Впервые был выведен из коры дерева красная восковница (Myrica rubra)[4].
По данным Министерства сельского хозяйства США, наиболее богаты следующие пищевые источники мирицетина: концентрат сока ежевики — 20,85 мг/100 г, сырой фенхель — 19,8 мг/100 г, петрушка — 14,84 мг/100 г, ягоды годжи (лайчи), сушеные — 11,4 мг/100 г [5]. По данным базы Phenol-Explorer, мирицетина в грецком орехе — 65,2 мг/100 г, голубика — 13.65 мг/100 г.[6]
Влияние на организм
правитьНесколько исследований in vitro и in vivo продемонстрировали полезные эффекты мирицетина, в том числе его антиоксидантный и противовоспалительный[7]. Мирицетин может стать перспективной пищевой добавкой для вспомогательных гипогликемических средств.[8]. Мирицетин может выполнять функции улучшения резистентности к инсулину, антиальдозные, антинеферментативные, гликирующие и гиполипидемические функции, которые могут внести свой вклад в профилактику сахарного диабета и диабетических осложнений.[9]
Мирицетин улучшает когнитивную функцию у мышей[7].
Исследование показало, что пищевой флавоноид мирицетин значительно подавлял экспрессию гепсидина, главного регулятора гомеостаза железа, увеличивал количество эритроцитов и уровень гемоглобина. Может представлять собой новую терапию для лечения заболеваний, связанных с дефицитом железа.[10]
Антимикробная активность
правитьЯвляется очень перспективным соединением для предотвращения распространения ВИЧ[11]. Оказывает определенное терапевтическое действие на COVID-19[12]. Мирицетин проявляет свою противовирусную активность в отношении вируса бронхита[13].
Противоопухолевое действие
правитьМногочисленные исследования подтвердили, что мирицетин обладает сильным противораковым действием против различных видов рака посредством различных механизмов.
Мирицетин ингибирует пролиферацию опухолевых клеток при следующих заболеваниях:
- рак печени[14],
- лейкемия[15],
- рак молочной железы[16][17][18],
- хориокарцинома плаценты человека[19],
- остеосаркома собак[20],
- кишечная неоплазия[21].
Мирицетин индуцирует апоптоз раковых клеток при следующих заболеваниях:
- рак яичников[22],
- хориокарцинома плаценты человека[19],
- рак толстой кишки[23][24],
- глиома[25][26][27],
- рак печени[28],
- рак щитовидной железы[29][30].
Мирицетин подавляет распространение и проникновение раковых клеток в соседние ткани при следующих заболеваниях: хориокарцинома плаценты человека[19], рак молочной железы[31], холангиокарцинома[32], рак печени[33], рак простаты[34], глиома[25].
Биодоступность
правитьФармакокинетическое исследование показало, что биодоступность мирицетина составила 9,62% и 9,74% при двух пероральных дозах (50 мг/кг и 100 мг/кг, соответственно), что свидетельствует о слабой абсорбции мирицетина после перорального приема[35].
Примечания
править- ↑ Riccardo Flamini, Fulvio Mattivi, Mirko De Rosso, Panagiotis Arapitsas, Luigi Bavaresco. Advanced Knowledge of Three Important Classes of Grape Phenolics: Anthocyanins, Stilbenes and Flavonols (англ.) // International Journal of Molecular Sciences. — 2013-10. — Vol. 14, iss. 10. — P. 19651–19669. — ISSN 1422-0067. — doi:10.3390/ijms141019651. Архивировано 19 июня 2022 года.
- ↑ Julie A. Ross, Christine M. Kasum. DIETARY FLAVONOIDS: Bioavailability, Metabolic Effects, and Safety // Annual Review of Nutrition. — 2002-07-01. — Т. 22, вып. 1. — С. 19–34. — ISSN 0199-9885. — doi:10.1146/annurev.nutr.22.111401.144957. Архивировано 7 июля 2022 года.
- ↑ Abdelkader Basli, Stéphanie Soulet, Nassima Chaher, Jean-Michel Mérillon, Mohamed Chibane. Wine Polyphenols: Potential Agents in Neuroprotection (англ.) // Oxidative Medicine and Cellular Longevity. — 2012-07-05. — Vol. 2012. — P. e805762. — ISSN 1942-0900. — doi:10.1155/2012/805762. Архивировано 4 июня 2022 года.
- ↑ Xiaominting Song, Lu Tan, Miao Wang, Chaoxiang Ren, Chuanjie Guo. Myricetin: A review of the most recent research (англ.) // Biomedicine & Pharmacotherapy. — 2021-02-01. — Vol. 134. — P. 111017. — ISSN 0753-3322. — doi:10.1016/j.biopha.2020.111017. Архивировано 19 июня 2022 года.
- ↑ Kwang-Su Park, Youhoon Chong, Mi Kyoung Kim. Myricetin: biological activity related to human health (англ.) // Applied Biological Chemistry. — 2016-04-01. — Vol. 59, iss. 2. — P. 259–269. — ISSN 2468-0842. — doi:10.1007/s13765-016-0150-2.
- ↑ Showing all foods in which the polyphenol Myricetin is found. Дата обращения: 19 июня 2022. Архивировано 3 марта 2022 года.
- ↑ 1 2 Yu Shimada, Yuka Sato, Motofumi Kumazoe, Ryo Kitamura, Yoshinori Fujimura. Myricetin improves cognitive function in SAMP8 mice and upregulates brain-derived neurotrophic factor and nerve growth factor (англ.) // Biochemical and Biophysical Research Communications. — 2022-08-06. — Vol. 616. — P. 33–40. — ISSN 0006-291X. — doi:10.1016/j.bbrc.2022.05.039.
- ↑ Junqing Qian, Jinqiu Zhang, Yan Chen, Chengen Dai, Jing Fan. Hypoglycemic activity and mechanisms of myricetin // Natural Product Research. — 2022-04-04. — Т. 0, вып. 0. — С. 1–4. — ISSN 1478-6419. — doi:10.1080/14786419.2022.2058941.
- ↑ Yong Li, Ye Ding. Minireview: Therapeutic potential of myricetin in diabetes mellitus (англ.) // Food Science and Human Wellness. — 2012-12-01. — Vol. 1, iss. 1. — P. 19–25. — ISSN 2213-4530. — doi:10.1016/j.fshw.2012.08.002. Архивировано 19 июня 2022 года.
- ↑ Mingdao Mu, Peng An, Qian Wu, Xiaoyun Shen, Dandan Shao. The dietary flavonoid myricetin regulates iron homeostasis by suppressing hepcidin expression (англ.) // The Journal of Nutritional Biochemistry. — 2016-04-01. — Vol. 30. — P. 53–61. — ISSN 0955-2863. — doi:10.1016/j.jnutbio.2015.10.015.
- ↑ Joseph T. Ortega, Alirica I. Suárez, Maria L. Serrano, Jani Baptista, Flor H. Pujol. The role of the glycosyl moiety of myricetin derivatives in anti-HIV-1 activity in vitro // AIDS Research and Therapy. — 2017-10-12. — Т. 14, вып. 1. — С. 57. — ISSN 1742-6405. — doi:10.1186/s12981-017-0183-6.
- ↑ Wilfred Ngwa, Rajiv Kumar, Daryl Thompson, William Lyerly, Roscoe Moore. Potential of Flavonoid-Inspired Phytomedicines against COVID-19 (англ.) // Molecules. — 2020-01. — Vol. 25, iss. 11. — P. 2707. — ISSN 1420-3049. — doi:10.3390/molecules25112707. Архивировано 19 июня 2022 года.
- ↑ Shuwei Peng, Chunlin Fang, Heng He, Xu Song, Xinghong Zhao. Myricetin exerts its antiviral activity against infectious bronchitis virus by inhibiting the deubiquitinating activity of papain-like protease (англ.) // Poultry Science. — 2022-03-01. — Vol. 101, iss. 3. — P. 101626. — ISSN 0032-5791. — doi:10.1016/j.psj.2021.101626. Архивировано 18 июня 2022 года.
- ↑ Minjing Li, Jinliang Chen, Xiaofei Yu, Sen Xu, Defang Li. Myricetin Suppresses the Propagation of Hepatocellular Carcinoma via Down-Regulating Expression of YAP (англ.) // Cells. — 2019-04. — Vol. 8, iss. 4. — P. 358. — ISSN 2073-4409. — doi:10.3390/cells8040358. Архивировано 19 июня 2022 года.
- ↑ Huiling Pan, Qian Hu, Jingyuan Wang, Zehui Liu, Dang Wu. Myricetin is a novel inhibitor of human inosine 5′-monophosphate dehydrogenase with anti-leukemia activity (англ.) // Biochemical and Biophysical Research Communications. — 2016-09-02. — Vol. 477, iss. 4. — P. 915–922. — ISSN 0006-291X. — doi:10.1016/j.bbrc.2016.06.158.
- ↑ Soma Mondal, Jagannath Jana, Pallabi Sengupta, Samarjit Jana, Subhrangsu Chatterjee. Myricetin arrests human telomeric G-quadruplex structure: a new mechanistic approach as an anticancer agent (англ.) // Molecular BioSystems. — 2016-07-19. — Vol. 12, iss. 8. — P. 2506–2518. — ISSN 1742-2051. — doi:10.1039/C6MB00218H. Архивировано 19 июня 2022 года.
- ↑ Allison Knickle, Wasundara Fernando, Anna L. Greenshields, H. P. Vasantha Rupasinghe, David W. Hoskin. Myricetin-induced apoptosis of triple-negative breast cancer cells is mediated by the iron-dependent generation of reactive oxygen species from hydrogen peroxide (англ.) // Food and Chemical Toxicology. — 2018-08-01. — Vol. 118. — P. 154–167. — ISSN 0278-6915. — doi:10.1016/j.fct.2018.05.005.
- ↑ De Jiao, Xue Dong Zhang. Myricetin suppresses p21-activated kinase 1 in human breast cancer MCF-7 cells through downstream signaling of the β-catenin pathway // Oncology Reports. — 2016-07-01. — Т. 36, вып. 1. — С. 342–348. — ISSN 1021-335X. — doi:10.3892/or.2016.4777. Архивировано 15 июня 2022 года.
- ↑ 1 2 3 Changwon Yang, Whasun Lim, Fuller W. Bazer, Gwonhwa Song. Myricetin suppresses invasion and promotes cell death in human placental choriocarcinoma cells through induction of oxidative stress (англ.) // Cancer Letters. — 2017-07-28. — Vol. 399. — P. 10–19. — ISSN 0304-3835. — doi:10.1016/j.canlet.2017.04.014.
- ↑ Hahyun Park,Sunwoo Park,Fuller W. Bazer,Whasun Lim. Myricetin treatment induces apoptosis in canine osteosarcoma cells by inducing DNA fragmentation, disrupting redox homeostasis, and mediating loss of mitochondrial membrane potential. — 2018. Архивировано 19 июня 2022 года.
- ↑ Ye Li, Shu-Xiang Cui, Shi-Yue Sun, Wen-Na Shi, Zhi-Yu Song. Chemoprevention of intestinal tumorigenesis by the natural dietary flavonoid myricetin in APC Min/+ mice (англ.) // Oncotarget. — 2016-08-06. — Vol. 7, iss. 37. — P. 60446–60460. — ISSN 1949-2553. — doi:10.18632/oncotarget.11108. Архивировано 15 июня 2022 года.
- ↑ Ye Xu, Qi Xie, Shaohua Wu, Dan Yi, Yang Yu. Myricetin induces apoptosis via endoplasmic reticulum stress and DNA double-strand breaks in human ovarian cancer cells // Molecular Medicine Reports. — 2016-03-01. — Т. 13, вып. 3. — С. 2094–2100. — ISSN 1791-2997. — doi:10.3892/mmr.2016.4763. Архивировано 19 июня 2022 года.
- ↑ Long Ma, Xiuqi Cao, Haiyue Wang, Kui Lu, Ying Wang. Discovery of Myricetin as a Potent Inhibitor of Human Flap Endonuclease 1, Which Potentially Can Be Used as Sensitizing Agent against HT-29 Human Colon Cancer Cells (англ.) // Journal of Agricultural and Food Chemistry. — 2019-02-13. — Vol. 67, iss. 6. — P. 1656–1665. — ISSN 1520-5118 0021-8561, 1520-5118. — doi:10.1021/acs.jafc.8b05447. Архивировано 19 июня 2022 года.
- ↑ Jeong Hyun Lee, Yong Jun Choi, See-Hyoung Park, Myeong Jin Nam. Potential role of nucleoside diphosphate kinase in myricetin-induced selective apoptosis in colon cancer HCT-15 cells (англ.) // Food and Chemical Toxicology. — 2018-06-01. — Vol. 116. — P. 315–322. — ISSN 0278-6915. — doi:10.1016/j.fct.2018.04.053.
- ↑ 1 2 Hua-Fu Zhao, Gang Wang, Chang-Peng Wu, Xiu-Ming Zhou, Jing Wang. A Multi-targeted Natural Flavonoid Myricetin Suppresses Lamellipodia and Focal Adhesions Formation and Impedes Glioblastoma Cell Invasiveness and Abnormal Motility (англ.) // CNS & Neurological Disorders - Drug Targets. — Vol. 17, iss. 7. — P. 557–567. — doi:10.2174/1871527317666180611090006. Архивировано 19 июня 2022 года.
- ↑ Xiang-Jun Tang, Kuan-Ming Huang, Hui Gui, Jun-Jie Wang, Jun-Ti Lu. Pluronic-based micelle encapsulation potentiates myricetin-induced cytotoxicity in human glioblastoma cells (англ.) // International Journal of Nanomedicine. — 2016-10-03. — Т. 11. — С. 4991–5002. — doi:10.2147/IJN.S114302. Архивировано 17 июня 2022 года.
- ↑ Li, H.-G., Chen, J.-X., Xiong, J.-H., Zhu, J.-W. Myricetin exhibits anti-glioma potential by inducing mitochondrial-mediated apoptosis, cell cycle arrest, inhibition of cell migration and ROS generation. — 2016.
- ↑ Enayatollah Seydi, Hamid Reza Rasekh, Ahmad Salimi, Zhaleh Mohsenifar, Jalal Pourahmad. Myricetin Selectively Induces Apoptosis on Cancerous Hepatocytes by Directly Targeting Their Mitochondria (англ.) // Basic & Clinical Pharmacology & Toxicology. — 2016-09. — Vol. 119, iss. 3. — P. 249–258. — doi:10.1111/bcpt.12572. Архивировано 19 июня 2022 года.
- ↑ Sunhyo Jo, Tae Kwun Ha, Sang-Hun Han, Mi Eun Kim, Inae Jung. Myricetin Induces Apoptosis of Human Anaplastic Thyroid Cancer Cells via Mitochondria Dysfunction (англ.) // Anticancer Research. — 2017-04-01. — Vol. 37, iss. 4. — P. 1705–1710. — ISSN 1791-7530 0250-7005, 1791-7530. — doi:10.21873/anticanres.11502. Архивировано 19 июня 2022 года.
- ↑ Tae Kwun Ha, Inae Jung, Mi Eun Kim, Sung Kwon Bae, Jun Sik Lee. Anti-cancer activity of myricetin against human papillary thyroid cancer cells involves mitochondrial dysfunction–mediated apoptosis (англ.) // Biomedicine & Pharmacotherapy. — 2017-07-01. — Vol. 91. — P. 378–384. — ISSN 0753-3322. — doi:10.1016/j.biopha.2017.04.100.
- ↑ Yingqian Ci, Yubo Zhang, Yanjie Liu, Shuai Lu, Jianhua Cao. Myricetin suppresses breast cancer metastasis through down-regulating the activity of matrix metalloproteinase (MMP)-2/9 (англ.) // Phytotherapy Research. — 2018-07. — Vol. 32, iss. 7. — P. 1373–1381. — doi:10.1002/ptr.6071. Архивировано 19 июня 2022 года.
- ↑ Tuponchai. Myricetin ameliorates cytokine-induced migration and invasion of cholangiocarcinoma cells via suppression of STAT3 pathway. www.cancerjournal.net. Дата обращения: 19 июня 2022. Архивировано 20 июня 2021 года.
- ↑ Hongxin Ma, Lei Zhu, Jingna Ren, Benlong Rao, Maomao Sha. Myricetin inhibits migration and invasion of hepatocellular carcinoma MHCC97H cell line by inhibiting the EMT process // Oncology Letters. — 2019-12-01. — Т. 18, вып. 6. — С. 6614–6620. — ISSN 1792-1074. — doi:10.3892/ol.2019.10998. Архивировано 19 июня 2022 года.
- ↑ Chen Ye, Chao Zhang, Hai Huang, Bo Yang, Guangan Xiao. The Natural Compound Myricetin Effectively Represses the Malignant Progression of Prostate Cancer by Inhibiting PIM1 and Disrupting the PIM1/CXCR4 Interaction (англ.) // Cellular Physiology and Biochemistry. — 2018. — Т. 48, вып. 3. — С. 1230–1244. — ISSN 1421-9778 1015-8987, 1421-9778. — doi:10.1159/000492009. Архивировано 19 июня 2022 года.
- ↑ Y. Dang, G. Lin, Y. Xie, J. Duan, P. Ma. Quantitative Determination of Myricetin in Rat Plasma by Ultra Performance Liquid Chromatography Tandem Mass Spectrometry and its Absolute Bioavailability (англ.) // Drug Research. — 2014-10. — Vol. 64, iss. 10. — P. 516–522. — ISSN 2194-9387 2194-9379, 2194-9387. — doi:10.1055/s-0033-1363220. Архивировано 3 июня 2018 года.