Необходимо перенести содержимое этой статьи в статью Инозитол и заменить эту статью на перенаправление. |
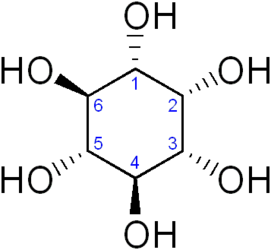
Мио-инозитол[источник не указан 2848 дней] (i-инозит; мезо-инозит; мио-инозит; 1,2,3,5-цис-4,6-циклогексангексол; дамбоза[1]) — один из 9 стереоизомеров шестиатомного спирта инозитола. Мио-инозитол и его производные выступают в качестве важных передатчиков сигнала во внутриклеточных сигнальных каскадах в форме различных инозитолфосфатов и фосфатидилинозитоловых липидов, участвуя в регуляции уровней внутриклеточного кальция[2], передаче сигнала от рецептора инсулина[3], расщеплении жиров и снижении уровня холестерина в крови[4], модуляции активности нейротрансмиттеров.
| Мио-инозитол | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
цис-1,2,3,5-транс-4,6-циклогексангексол |
| Традиционные названия | Циклогексангексол, фазеоманнитол, миоинозитол |
| Хим. формула | C6H12O6 |
| Физические свойства | |
| Состояние | кристаллический порошок |
| Молярная масса | 180,16 г/моль |
| Плотность | 1,752 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 225–227 °C |
| • разложения | 315 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 2,512; 4,1515 г/100 мл |
| • в этаноле | трудно растворим |
| • в диэтиловом эфире | нерастворим |
| Классификация | |
| Рег. номер CAS | 87-89-8 |
| PubChem | 892 |
| Рег. номер EINECS | 201-781-2 |
| SMILES | |
| InChI | |
| ChEBI | 17268 |
| ChemSpider | 10239179 |
| Безопасность | |
| Токсичность | низкотоксичен (прием 2—4 г полностью безопасен) |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Содержание в продуктах питания
правитьМио-инозитол или его фосфат-производные содержатся во фруктах (особенно в дынях и апельсинах), также встречается в бобовых, зернах, орехах[5].
В растениях, мио-инозитол встречается в основном в форме гексафосфата мио-инозитола (т. н. фитиновой кислоты) и её солей, фитатов, которые служат источником фосфатов для прорастающего семени. Фитиновая кислота плохо усваивается организмом человека. Кроме того, фитаты также хелатируют многие эссенциальные минералы (кальций, магний, железо, цинк), существенно снижая их биоусвояемость и внося вклад в формирование дефицитов минералов и нарушений электролитного баланса организма[6].
Мио-инозитол представлен в значительном количестве продуктов питания. Однако в таблицах, описывающих содержание мио-инозитола в различных продуктах, не всегда делается различие между физиологически активной формой (то есть самим мио-инозитолом) и низкоактивной формой — фитиновой кислотой[5]. Наиболее высокое содержание всех форм мио-инозитола установлено в проростках пшеницы (700 мг/100г), рисовых отрубях (460 мг/100 г), свежем зелёном горохе (240 мг/100г) и апельсинах (210мг/100г).
Содержание в различных препаратах
правитьВ лечебных дозировках, мио-инозитол выпускается в оригинальном препарате «Иноферт» (1000 мг/саше)[7][8], а также в аналогах: «Миофертал» (1000 мг/пакетик-стик)[9], «Фертина» (1000 мг/саше)[10][11] и «Миофолик» (2000 мг/саше)[12][13]. Мио-инозитол включен в состав ряда витаминно-минеральных комплексов: «Актиферт-Андро» для повышения мужской фертильности, «Витрум Бьюти» (20 мг/таб), «Лэдис — формула для кожи, волос и ногтей» (10 мг/таб). Мио-инозитол и D-хиро-инозитол — активные компоненты витаминно-минерального комплекса «Дикироген» (мио-инозитол 1000 мг, D-хиро-инозитол 200 мг, марганец 5 мг, фолиевая кислота 200 мкг) для улучшения функционального состояния женской репродуктивной системы, в том числе при прегравидарной подготовке[14]. Мио-инозитол входит в состав гепатопротекторного препарата «Прогепар» в количестве 25 мг/драже[15].
Рекомендуемые уровни суточного потребления миоинозитола составляют для взрослых — 500 мг/сутки; для детей 4—6 лет — 80—100 мг/сутки; для детей 7—18 лет от 200 до 500 мг/сутки[16]. Верхний уровень потребления не установлен. В клинической практике используются дозы 2000—4000 мг/сут (при синдроме поликистозных яичников и подготовке к ЭКО) и даже 12000 мг/сут (в психиатрической практике, см. далее).
Краткая история исследования мио-инозитола
править- 1848 — немецкий химик Ю. Либих выделил из проростков пшеницы и назвал его миоинозитолом.
- 1902 — миоинозитол вошёл в классификацию витаминов как витамин В8 или «витамин юности».
- 1941 — Гэвин и МакГенри установили липотропное действие инозитола.[17]
- 1986 — Рапейко с соавт. обнаружили у миоинозитола способность нормализовать уровни холестерина.[4]
- 2011 — Кондорелли с соавт. обнаружили, что миоинозитол регулирует осмолярность и объём семенной плазмы, экспрессию белков, необходимых для эмбриогенетического развития и подвижность сперматозодидов, эффективен при мужском бесплодии.[18]
- 2013 — Биоинформационный анализ протеома человека позволил систематизировать данные по всем известным инозитол-зависимым белкам и их роли в физиологии человека[19].
Биоинформационный и системно-биологический анализ
правитьДесятки разновидностей рецепторов (например, метаботропные глутаматные, гистаминовые, ГАМК и т. д.), которые расположены на клеточной мембране, будучи активированы, задействуют специальные сигнальные белки (как правило, ферменты — киназы (в том числе фосфоинозитид-3-киназы PI3K, фосфолипазы и др.), приводящие к секреции кальция из эндоплазматического ретикулума клетки в цитозоль. Кальций, диацилглицерол, цАМФ и различные фосфат-производные миоинозитола (фосфатидилинозитол и другие) являются эссенциальными «вторичными сигналами» («secondary messenger»), участвующими в регуляции каскадных механизмов, осуществляющих биологические роли соответствующих рецепторов.
К настоящему времени известны десятки белков, участвующих во внутриклеточных сигнальных каскадах от рецепторов с участием кальция и производных миоинозитола. Поиски в базе данных публикаций Medline и в других базах данных позволили установить и систематически описать все эти белки. Так, было установлено существование 233 белков, так или иначе принимающих участие в передаче внутриклеточных сигналов посредством производных миоинозитола. Для большей части этих белков биологические роли недостаточно изучены. Тем не менее, в ходе дальнейшего анализа удалось выделить около 120 инозитолфосфат-зависимых белков, для которых имеется достоверная информация об их специфическом участии в различных физиологических процессах[19]. Суммарная информация о физиологических ролях этих сигнальных белков представлена на рисунке.
Результаты системно-биологического анализа белков протеома человека анализа подтверждаются экспериментальными и клиническими исследованиями. Миоинозитол действительно участвует в поддержке жизнедеятельности сердечно-сосудистой системы[20], иммунитета (снижение аутоиммунных воспалительных реакций[21]). Не менее важны роли миоинозитола в ЦНС (регулировка уровней нейронально-глиального метаболита миоинозитола нарушена в случае когнитивных расстройств, депрессии и диабета[22]), метаболизме сахаров (прежде всего, в сигнальном каскаде инсулина[23]) и в функционировании почек[24] и печени. Взаимодействия производных инозитола во взаимодействии со специфическими белками, участвующими в функционировании репродуктивной системы соответствует известному акушерско-гинекологическому применению препаратов миоинозитола в терапии заболевания, известного как синдром поликистозных яичников (СПКЯ)[25].
Клинические исследования
правитьМиоинозитол и диабет
правитьЯвляясь т. н. «вторичным сигналом», фосфат-производные миоинозитола, совместно с ионами кальция и магния, осуществляют передачу сигнала от инсулинового рецептора внутрь клеток различных тканей . Эти внутриклеточные процессы приводят к повышению экспрессии транспортёра глюкозы, инициируют процессы адсорбции рецептора инсулина, стимулируют переработку углеводов и жиров для поддержания энергетического метаболизма клетки и необходимы для снижения риска инсулинрезистентности, диабета, избыточного веса и ожирения[19].
В исследовании группы 101 диабетика и 212 здоровых добровольцев, уровни миоинозитола в моче у пациентов с диабетом были значительно выше (37±37 нг/л), чем в контрольной группе (8±13 нг/л, р<0,001). Средняя аккуратность распознавания пациентов с диабетом по произведению уровней миоинозитола на уровни D-хироинозитола в моче составила 84 % (доверительный интервал 79—89 %, р<0,001)[26].
Эффекты приёма добавок миоинозитола на инсулинрезистентность у пациенток с гестационным диабетом исследовались в группе 69 пациенток. Группа была рандомизирована на получение миоинозитола (4000 мг/сут) и фолиевой кислоты (400 мкг/сут) или только фолиевой кислоты (контроль). Прием миоинозитола приводил к снижению уровней глюкозы натощак и инсулина, так что оценка по модели гомеостаза резистентности к инсулину достоверно снизилась у 50 % участниц в основной группе и только у 29 % в контрольной (р=0,0001). Миоинозитол также способствовал повышению уровней адипонектина (р = 0,009)[27].
Миоинозитол и функция ЦНС
правитьМиоинозитол необходим для поддержки нейрональной функции, включая синаптическую передачу и осуществление физиологических эффектов таких нейротрансмиттеров как серотонин, дофамин, ГАМК, нейромедин. Производные миоинозитола также обеспечивают энергетический метаболизм в ЦНС (через участие в каскаде рецептора инсулина) и вовлечены в защиту нейронов от клеточного стресса[19].
Исследование пациентов с умеренными когнитивными нарушениями методом МР-спектроскопии (1Н MRS), позволяющим оценивать уровни таких молекул как N-ацетиласпартат, холин, миоинозитол, глутамин в ткани головного мозга пациентов указало на значимые различия (р <0,05) в значении отношения миоинозитол/вода в левой лобной доле при когнитивных нарушениях при сравнении данными для здоровых участников[28].
Воздействие миоинозитола на метаболизм и биологическую активность возбуждающих и тормозящих нейротрансмиттеров позволяет предположить, что миоинозитол может быть полезным для пациенты с нейрохимическими нарушениями (как правило, это психиатрические пациенты). Предварительные результаты исследований показали, высокие дозы очищенного миоинозитола могут помогать пациентам, страдающих от таких проблем булимия, паническое расстройство, обсессивно-компульсивное расстройство, агорафобия, однополярная и биполярная депрессия. Например, в двойном слепом исследовании 13 пациентов, миоинозитол (18 г/сут) уменьшал симптомы обсессивно-компульсивного расстройства с эффективностью повсеместно используемых но более опасных средств СИОЗС (селективные ингибиторы обратного захвата серотонина), причём при практически полном отсутствии побочных эффектов[29]. В другом двойном слепом контролируемом исследовании, миоинозитол (18 г/сут) показал лучшую эффективность чем флувоксамин (с точки зрения снижения количества приступов паники и других побочных эффектов)[30]. Применение 12 г/сут миоинозитола в двойном слепом, плацебо-контролируемом исследовании пациентов с депрессией привело к значительному улучшению симптомов, без негативных изменений в печени, почках, или гематологических функциях[31].
Миоинозитол и поддержка функции яичников
правитьСпецифические воздействия миоинозитола на репродуктивную функцию связаны с участием производных миоинозитола в сигнальных каскадах белковых рецепторов гонадолиберина (гонадотропин-высвобождающий гормон, ГНВГ), лютеинизирующего гормона (ЛГ) и фолликуло-стимулирующего гормона (ФСГ). Непосредственное участие миоинозитола в процессах гормональной регуляции менструального цикла обуславливает успешное применение миоинозитола у пациенток с ановуляторным циклом[19]. Если проследить ряд исследований с использованием разных доз миоинозитола, то наблюдается тенденция дозозависимости и долговременности курсового приема. Например, прием миоинозитола в количестве 2 г/сут за 24 нед. приема позволяет снизить ановуляторные циклы в 4 раза, а прием в дозе 4 г/сут — за 3—4 недели[20].
Участие миоинозитола в передаче сигнала от рецептора инсулина и осуществлении эффектов ГНВГ, ЛГ, ФСГ обеспечивает более полное вызревание ооцитов при приеме миоинозитола. Проспективное, контролируемое, рандомизированное исследование показало, что миоинозитол улучшает функциональное состояние ооцитов у пациентов с СПКЯ, прошедших циклы интрацитоплазматических инъекций сперматозоидов (ИКСИ)[32].
Миоинозитол в подготовке к экстракорпоральному оплодотворению (ЭКО)
правитьЭкстракорпоральное оплодотворение — вспомогательная репродуктивная технология, используемая в случае бесплодия. Во время ЭКО яйцеклетку извлекают из организма женщины и оплодотворяют искусственно, «in vitro» (условно, «в пробирке»), полученный эмбрион содержат в условиях инкубатора, где он развивается в течение 2—5 дней, после чего эмбрион переносят в полость матки для дальнейшего развития. Использование миоинозитола в программах подготовки к ЭКО повышает зрелость ооцитов, позволяет снизить гормональную нагрузку и повысить эффективность процедуры. Использование при проведении ЭКО миоинозитола в сочетании с D-хироинозитолом в физиологическом соотношении (1,1 г/сут миоинозитола, 27 мг/сут D-хироинозитола) приводило к улучшению качества ооцитов и эмбрионов по сравнению с приемом только 500 мг D-хироинозитола[33].
Добавление миоинозитола к фолиевой кислоте у пациенток без СПКЯ, проходящих циклы стимуляции фолликул для ЭКО, позволяет уменьшить число используемых зрелых ооцитов и сократить дозировку рФСГ без уменьшения числа клинических беременностей. В группе женщин (n=100) в возрасте <40 лет без СПКЯ и с базальным уровнем ФСГ<10 МЕ/мл, пациентки получали рФСГ (150 МЕ) в течение 6 дней. За 3 месяца до начала процедур ЭКО, группа была рандомизирована на получение миоинозитола и фолиевой кислоты (n=50) или только фолиевой кислоты (n=50). Использование миоинозитола позволило снизить общее количество гонадотропина, число использованных ооцитов, увеличить число случаев успешной имплантации ооцитов[34].
Миоинозитол также оказывает воздействие на функционирование сперматозоидов, регулируя осмолярность и объём семенной плазмы, экспрессию белков, необходимых для эмбриогенетического развития и подвижность сперматозодидов. Достаточные концентрации миоинозитола в питательной среде культуры клеток значительно увеличивает процент подвижных сперматозоидов как у здоровых контролей, так и у пациентов с олиго-астено-тератозооспермией. Улучшение подвижности в последней группе было связано, в частности, со значительным увеличением доли сперматозоидов с высоким митохондриальным мембранным потенциалом[18].
Миоинозитол в терапии СПКЯ
правитьМиоинозитол и его производные необходимы для осуществления эффектов гонадотропина, лютеинизирующего и фолликул-стимулирующего гормонов, тем самым оказывая пространное влияние на функционирование репродуктивной системы и фертильность (инвазия трофобласта при закреплении бластоцисты, функции яичников, ооцитов, плаценты). Синдром поликистозных яичников (СПКЯ) является основной причиной бесплодия вследствие метаболических, гормональных дисфункций и яичников[19]. У пациенток, СПКЯ часто коморбиден с инсулинорезистентностью и с компенсаторной гиперинсулинемией. Комбинированная терапия СПКЯ с включением миоинозитола снижает риск нарушения обмена веществ при СПКЯ у пациенток с избыточной массой тела, проявляя благотворное влияние на уровне метаболизма, состояния гормональной регуляции и функции яичников. Эффекты миоинозитола у женщин с СПКЯ были изучены в систематическом анализе рандомизированных контролируемых исследований. В целом, результаты анализа позволяют рекомендовать использование миоинозитола для улучшения функции яичников, а также метаболических и гормональных показателей у пациенток с СПКЯ[35].
Обсервационное исследование (Pedro-Antonio Regidor, Adolf Eduard Schindler)[36] мио-инозитола, как безопасного и альтернативного подхода при лечении бесплодия у женщин с СПКЯ показало, что использование 2×2000 мг мио-инозитола + 2×200 мкг фолиевой кислоты в день (которые содержатся в двух саше «Миофолик»[12]) является безопасным и многообещающим инструментом для эффективного улучшения симптомов бесплодия у пациенток с синдромом поликистозных яичников (СПКЯ).
Рандомизированное, двойное слепое, плацебо-контролируемое исследование эффектов миоинозитола в группе 92 женщин с СПКЯ указало на достоверное улучшение функций яичников. Пациентки контрольной группы (n=47) получали 400 мкг фолиевой кислоты в качестве плацебо, а пациентки основной группы (n=45) миоинозитол плюс фолиевую кислоту (4 г/сут миоинозитола, 400 мкг/сут фолиевой кислоты, в виде препарата «Иноферт», 1000 мг/саше). Уровни эстрадиола достоверно были выше в основной группе начиная уже с первой недели лечения. Прием миоинозитола способствовал увеличению уровней липопротеинов высокой плотности. В основной группе частота овулирущих пациенток была выше (25 %, плацебо — 15 %), а время до первой овуляции существенно короче (25 сут, 95 % ДИ 18—31; плацебо — 41 сут, 95 % ДИ 27—54, Р<0,05). Существенного улучшения не было отмечено у пациенток с тяжёлой формой ожирения (ИМТ>37)[37].
Снижение избыточной секреции андрогенов, гирсутизма и акне
правитьХарактерная для СПКЯ гиперинсулинемия способствует нарушениям метаболизма андрогенов, что проявляется как гирсутизм, акне и андрогенное ожирение. Взаимосвязь между нарушением прохождения сигнала по каскаду инсулинового рецептора[19] с андрогенными нарушениями при СПКЯ подтверждена в клинических исследованиях: у пациенток с СПКЯ отмечены характерные изменения уровней сигнальных белков, называемых «субстраты инсулинового рецептора» 1-го, 2-го и 4-го типов (IRS-1/2) в текальных клетках яичников, которые могут играть важную роль в гиперандрогенизме яичников и текальной гиперплазии[38]. Увеличение уровней фермента синтеза тестостерона 17-альфа-гидроксилазы при стимуляции текальных клеток яичников инсулином опосредовано сигнальным белком каскада инсулинового рецептора фосфатидилинозитол-3-киназой (PI3K)[39].
Миоинозитол может использоваться для устранения андрогеновых нарушений. Например, 50 пациенток с СПКЯ получали 4 г/сут миоинозитола в течение 6 месяцев. Через 3 месяца приема миоинозитола уровни ЛГ, тестостерона, свободного тестостерона, инсулина в плазме существенно снизились. Гирсутизм и акне достоверно уменьшились после 6 месяцев терапии[40]. Изучение эффектов миоинозитола (4 г/сут, 12—16 нед.) в двойном слепом плацебо-контролируемом исследовании 42 пациенток с СПКЯ приводила к достоверным снижениям уровней тестостерона, триглицеридов, инсулина и способствовала нормализации АД и восстановлению овуляции. Уровень общего тестостерона снизился от 99±7 до 35±4 нг/дл (группа плацебо, от 116±15 до 109±8 нг/дл, p=0,003), свободного тестостерона сыворотки — от 0,85±0,1 до 0,24±0,33 нг/дл (группа плацебо: от 0,89±0,12 до 0,85±0,13 нг/дл, p=0,01)[41].
Миоинозитол и пороки развития
правитьДефициты миоинозитола и цинка являются факторами риска для формирования расщелины губы и/или «волчьей пасти». Наблюдения за 84 беременными, родивших детей с такими дефектами, и 102 беременными, родивших здоровых детей показали, что риск пороков развития был достоверно связан с более низкими уровнями цинка в эритроцитах у детей (р=0,003) и у их матерей (р=0,02). Низкие уровни миоинозитола сыворотки (<13,5 мкмоль/л) у матери соответствовали увеличению риска пороков развития в 3 раза (95 % ДИ 1,2—7,4). Низкий уровень миоинозитола сыворотки у детей (<21,5 мкмоль/л) соответствовал повышению риска пороков развития в 3,4 раза (95 % ДИ 1,3—8,6); низкие уровни цинка в эритроцита (<118 мкмоль/л) — повышению риска в 3,3 раза (95 % ДИ 1,3—8,0). Была установлена достоверная корреляция между уровнями миоинозитола у матери и у ребёнка (коэффициент корреляции 0,33, р=0,0006)[42].
Дефицит миоинозитол был ассоциирован с повышенным риском расщелин позвоночника при наблюдении 63 матерей и 70 детей с расщелиной позвоночника в сравнении с контрольной группой (102 матери, 85 детей). Уровни миоинозитола в сыворотке матерей были на 5 % (95 % ДИ 1—11 %) меньше у матерей в основной группе. Квартиль самых низких концентраций миоинозитола соответствовал повышению риска расщеплен позвоночника в 2,6 раза (95 % ДИ 1,1—6,0). В группе детей с ДНТ, уровни миоинозитола сыворотки были, в среднем, на 7 % ниже (95 % ДИ 0—14 %)[43].
У беременных с нарушениями метаболизма глюкозы и инсулинрезистентностью дети с пороками развития рождаются чаще. Роль миоинозитола в профилактике пороков развития связанных с нарушениями обмена углеводов трудно переоценить: производные миоинозитола участвуют в процессах передачи сигнала от инсулинового рецептора[44] (см. также выше). Низкие концентрации миоинозитола в ткани эмбриона на этапе органогенеза играют важную роль в индуцированнии эмбриопатий, вызываемых гипергликемией[45].
Прием миоинозитола профилактирует риск возникновения гестационного диабета (ГД) даже у женщин с семейной историей диабета 2-го типа. Например, в проспективном, рандомизированном, плацебо-контролируемом исследовании одна группа пациенток получала 4 г/сут миоинозитола и 400 мкг/сут фолиевой кислоты разделённые на приема (n=110), начиная с конца первого триместра. Участницы в группе плацебо (n=110) получали только 400 мкг/сут фолиевой кислоты. Заболеваемость ГД была значительно ниже при приеме миоинозитола — 6 %, контроль — 15,3 % (отношение шансов 0,35, р=0,04). При приеме миоинозитола также было отмечено статистически значимое снижение частоты макросомии (масса плода > 4000 г) и снижение средней массы плода в сторону середины интервала нормы[46].
Примечания
править- ↑ Справочник химика. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- ↑ Gerasimenko J. V., Flowerdew S. E., Voronina S. G., Sukhomlin T. K., Tepikin A. V., Petersen O. H., Gerasimenko O. V. Bile acids induce Ca2+ release from both the endoplasmic reticulum and acidic intracellular calcium stores through activation of inositol trisphosphate receptors and ryanodine receptors. (англ.) // The Journal of biological chemistry. — 2006. — Vol. 281, no. 52. — P. 40154—40163. — doi:10.1074/jbc.M606402200. — PMID 17074764.
- ↑ Larner J. D-chiro-inositol--its functional role in insulin action and its deficit in insulin resistance. (англ.) // International journal of experimental diabetes research. — 2002. — Vol. 3, no. 1. — P. 47—60. — PMID 11900279.
- ↑ 1 2 Rapiejko P. J., Northup J. K., Evans T., Brown J. E., Malbon C. C. G-proteins of fat-cells. Role in hormonal regulation of intracellular inositol 1,4,5-trisphosphate. (англ.) // The Biochemical journal. — 1986. — Vol. 240, no. 1. — P. 35—40. — PMID 3103610.
- ↑ 1 2 Clements, Rex; Betty Darnell. Myo-inositol content of common foods: development of a high-myo-inositol diet (англ.) // American Journal of Clinical Nutrition[англ.] : journal. — 1980. — Vol. 33, no. 9. — P. 1954—1967. — PMID 7416064. Архивировано 7 апреля 2008 года.
- ↑ Hurrell R. F. Influence of vegetable protein sources on trace element and mineral bioavailability. (англ.) // The Journal of nutrition. — 2003. — Vol. 133, no. 9. — P. 2973—2977. — PMID 12949395.
- ↑ рлснет.ру. Архивировано 22 октября 2013 года.
- ↑ Сайт производителя. Архивировано 19 октября 2013 года. Архивированная копия. Дата обращения: 18 октября 2013. Архивировано 19 октября 2013 года.
- ↑ Миофертал. Дата обращения: 23 июня 2020. Архивировано 25 июня 2020 года.
- ↑ Фертина Инозит 1000 мг. Дата обращения: 27 ноября 2018. Архивировано 27 ноября 2018 года.
- ↑ Фертина (англ.). www.orionpharma.ru. Дата обращения: 27 ноября 2018. Архивировано 27 ноября 2018 года.
- ↑ 1 2 Инновационный комплекс Миофолик. Miofolic. Дата обращения: 10 мая 2019. Архивировано 10 мая 2019 года.
- ↑ Миофолик для повышения фертильности у женщин и лечения СПКЯ. Амакса Україна. Дата обращения: 10 мая 2019. Архивировано 10 мая 2019 года.
- ↑ Дикироген. Дата обращения: 8 октября 2020.
- ↑ Инструкция по применению «Прогепар». Архивировано 19 октября 2013 года.
- ↑ Нормы физиологических потребностей в витаминах для мужчин и женщин (РФ, МР 2.3.1.2432-08) : журнал. Архивировано 17 октября 2013 года.
- ↑ Gavin G, McHenry EW. Inositol: a lipotropic factor. J. Bioi. Chem., 1941, 139:485
- ↑ 1 2 Condorelli R. A., La Vignera S., Di Bari F., Unfer V., Calogero A. E. Effects of myoinositol on sperm mitochondrial function in-vitro. (англ.) // European review for medical and pharmacological sciences. — 2011. — Vol. 15, no. 2. — P. 129—134. — PMID 21434479.
- ↑ 1 2 3 4 5 6 7 Громова О. А., Торшин И. Ю., Гришина Т. Р., Громов А. Н., Лиманова О. А. Систематический анализ молекулярно-физиологических эффектов миоинозитола: данные молекулярной биологии, экспериментальной и клинической медицины // Эффективная фармакотерапия. — 2013. — № 28. — С. 4—12.
- ↑ 1 2 Venturella R., Mocciaro R., De Trana E., D'Alessandro P., Morelli M., Zullo F. Assessment of the modification of the clinical, endocrinal and metabolical profile of patients with PCOS syndrome treated with myo-inositol (итал.) // Minerva ginecologica. — 2012. — Vol. 64, n. 3. — P. 239—243. — PMID 22635019.
- ↑ Young G. B., Hader W. J., Hiscock M., Warren K. G., Logan D. The role of myo-inositol in multiple sclerosis. (англ.) // Journal of neurology, neurosurgery, and psychiatry. — 1986. — Vol. 49, no. 3. — P. 265—272. — PMID 3007676.
- ↑ Haroon E., Watari K., Thomas A., Ajilore O., Mintz J., Elderkin-Thompson V., Darwin C., Kumaran S., Kumar A. Prefrontal myo-inositol concentration and visuospatial functioning among diabetic depressed patients. (англ.) // Psychiatry research. — 2009. — Vol. 171, no. 1. — P. 10—19. — doi:10.1016/j.pscychresns.2008.03.006. — PMID 19097871.
- ↑ Hacibekiroğlu M., Akçay T. The role of plasma, erythrocyte and platelet myo-inositol levels in the development of diabetic microangiopathy. (англ.) // Diabetes research (Edinburgh, Scotland). — 1994. — Vol. 25, no. 4. — P. 173—179. — PMID 7648788.
- ↑ Melmed S., Lewin L. M., Bank H. Myo-inositol clearance in renal failure and in patients with normal kidney function. (англ.) // The American journal of the medical sciences. — 1977. — Vol. 274, no. 1. — P. 55—59. — PMID 900156.
- ↑ Nordio M., Proietti E. The combined therapy with myo-inositol and D-chiro-inositol reduces the risk of metabolic disease in PCOS overweight patients compared to myo-inositol supplementation alone. (англ.) // European review for medical and pharmacological sciences. — 2012. — Vol. 16, no. 5. — P. 575—581. — PMID 22774396.
- ↑ Hong J. H., Jang H. W., Kang Y. E., Lee J. H., Kim K. S., Kim H. J., Park K. R., Ku B. J. Urinary chiro- and myo-inositol levels as a biological marker for type 2 diabetes mellitus. (англ.) // Disease markers. — 2012. — Vol. 33, no. 4. — P. 193—199. — doi:10.3233/DMA-2012-0925. — PMID 22960342.
- ↑ Corrado F., D'Anna R., Di Vieste G., Giordano D., Pintaudi B., Santamaria A., Di Benedetto A. The effect of myoinositol supplementation on insulin resistance in patients with gestational diabetes. (англ.) // Diabetic medicine : a journal of the British Diabetic Association. — 2011. — Vol. 28, no. 8. — P. 972—975. — doi:10.1111/j.1464-5491.2011.03284.x. — PMID 21414183.
- ↑ Walecki J., Barcikowska M., Ćwikła JB, Gabryelewicz T. N-acetylaspartate, choline, myoinositol, glutamine and glutamate (glx) concentration changes in proton MR spectroscopy (1H MRS) in patients with mild cognitive impairment (MCI). (англ.) // Medical science monitor : international medical journal of experimental and clinical research. — 2011. — Vol. 17, no. 12. — P. 105—111. — PMID 22129910.
- ↑ Fux M., Levine J., Aviv A., Belmaker R. H. Inositol treatment of obsessive-compulsive disorder. (англ.) // The American journal of psychiatry. — 1996. — Vol. 153, no. 9. — P. 1219—1221. — doi:10.1176/ajp.153.9.1219. — PMID 8780431.
- ↑ Palatnik A., Frolov K., Fux M., Benjamin J. Double-blind, controlled, crossover trial of inositol versus fluvoxamine for the treatment of panic disorder. (англ.) // Journal of clinical psychopharmacology. — 2001. — Vol. 21, no. 3. — P. 335—339. — PMID 11386498.
- ↑ Levine J., Barak Y., Gonzalves M., Szor H., Elizur A., Kofman O., Belmaker R. H. Double-blind, controlled trial of inositol treatment of depression. (англ.) // The American journal of psychiatry. — 1995. — Vol. 152, no. 5. — P. 792—794. — doi:10.1176/ajp.152.5.792. — PMID 7726322.
- ↑ Papaleo E., Unfer V., Baillargeon J. P., Fusi F., Occhi F., De Santis L. Myo-inositol may improve oocyte quality in intracytoplasmic sperm injection cycles. A prospective, controlled, randomized trial. (англ.) // Fertility and sterility. — 2009. — Vol. 91, no. 5. — P. 1750—1754. — doi:10.1016/j.fertnstert.2008.01.088. — PMID 18462730.
- ↑ Colazingari S., Treglia M., Najjar R., Bevilacqua A. The combined therapy myo-inositol plus D-chiro-inositol, rather than D-chiro-inositol, is able to improve IVF outcomes: results from a randomized controlled trial. (англ.) // Archives of gynecology and obstetrics. — 2013. — Vol. 288, no. 6. — P. 1405—1411. — doi:10.1007/s00404-013-2855-3. — PMID 23708322.
- ↑ Lisi F., Carfagna P., Oliva M. M., Rago R., Lisi R., Poverini R., Manna C., Vaquero E., Caserta D., Raparelli V., Marci R., Moscarini M. Pretreatment with myo-inositol in non polycystic ovary syndrome patients undergoing multiple follicular stimulation for IVF: a pilot study. (англ.) // Reproductive biology and endocrinology : RB&E. — 2012. — Vol. 10. — P. 52. — doi:10.1186/1477-7827-10-52. — PMID 22823904.
- ↑ Unfer V., Carlomagno G., Dante G., Facchinetti F. Effects of myo-inositol in women with PCOS: a systematic review of randomized controlled trials. (англ.) // Gynecological endocrinology : the official journal of the International Society of Gynecological Endocrinology. — 2012. — Vol. 28, no. 7. — P. 509—515. — doi:10.3109/09513590.2011.650660. — PMID 22296306.
- ↑ Adolf Eduard Schindler, Pedro-Antonio Regidor. Myoinositol as a Safe and Alternative Approach in the Treatment of Infertile PCOS Women: A German Observational Study (англ.). International Journal of Endocrinology (2016). Дата обращения: 10 мая 2019. Архивировано 10 мая 2019 года.
- ↑ Gerli S., Mignosa M., Di Renzo G. C. Effects of inositol on ovarian function and metabolic factors in women with PCOS: a randomized double blind placebo-controlled trial. (англ.) // European review for medical and pharmacological sciences. — 2003. — Vol. 7, no. 6. — P. 151—159. — PMID 15206484.
- ↑ Yen H. W., Jakimiuk A. J., Munir I., Magoffin D. A. Selective alterations in insulin receptor substrates-1, -2 and -4 in theca but not granulosa cells from polycystic ovaries. (англ.) // Molecular human reproduction. — 2004. — Vol. 10, no. 7. — P. 473—479. — doi:10.1093/molehr/gah066. — PMID 15155816.
- ↑ Munir I., Yen H. W., Geller D. H., Torbati D., Bierden R. M., Weitsman S. R., Agarwal S. K., Magoffin D. A. Insulin augmentation of 17alpha-hydroxylase activity is mediated by phosphatidyl inositol 3-kinase but not extracellular signal-regulated kinase-1/2 in human ovarian theca cells. (англ.) // Endocrinology. — 2004. — Vol. 145, no. 1. — P. 175—183. — doi:10.1210/en.2003-0329. — PMID 14512432.
- ↑ Zacchè M. M., Caputo L., Filippis S., Zacchè G., Dindelli M., Ferrari A. Efficacy of myo-inositol in the treatment of cutaneous disorders in young women with polycystic ovary syndrome. (англ.) // Gynecological endocrinology : the official journal of the International Society of Gynecological Endocrinology. — 2009. — Vol. 25, no. 8. — P. 508—513. — doi:10.1080/09513590903015544. — PMID 19551544.
- ↑ Costantino D., Minozzi G., Minozzi E., Guaraldi C. Metabolic and hormonal effects of myo-inositol in women with polycystic ovary syndrome: a double-blind trial. (англ.) // European review for medical and pharmacological sciences. — 2009. — Vol. 13, no. 2. — P. 105—110. — PMID 19499845.
- ↑ Krapels I. P., Rooij I. A., Wevers R. A., Zielhuis G. A., Spauwen P. H., Brussel W., Steegers-Theunissen R. P. Myo-inositol, glucose and zinc status as risk factors for non-syndromic cleft lip with or without cleft palate in offspring: a case-control study. (англ.) // BJOG : an international journal of obstetrics and gynaecology. — 2004. — Vol. 111, no. 7. — P. 661—668. — doi:10.1111/j.1471-0528.2004.00171.x. — PMID 15198755.
- ↑ Groenen P. M., Peer P. G., Wevers R. A., Swinkels D. W., Franke B., Mariman E. C., Steegers-Theunissen R. P. Maternal myo-inositol, glucose, and zinc status is associated with the risk of offspring with spina bifida. (англ.) // American journal of obstetrics and gynecology. — 2003. — Vol. 189, no. 6. — P. 1713—1719. — PMID 14710103.
- ↑ Carlomagno G., Unfer V. Inositol safety: clinical evidences. (англ.) // European review for medical and pharmacological sciences. — 2011. — Vol. 15, no. 8. — P. 931—936. — PMID 21845803.
- ↑ Akashi M., Akazawa S., Akazawa M., Trocino R., Hashimoto M., Maeda Y., Yamamoto H., Kawasaki E., Takino H., Yokota A. Effects of insulin and myo-inositol on embryo growth and development during early organogenesis in streptozocin-induced diabetic rats. (англ.) // Diabetes. — 1991. — Vol. 40, no. 12. — P. 1574—1579. — PMID 1756898.
- ↑ D'Anna R., Scilipoti A., Giordano D., Caruso C., Cannata M. L., Interdonato M. L., Corrado F., Di Benedetto A. myo-Inositol supplementation and onset of gestational diabetes mellitus in pregnant women with a family history of type 2 diabetes: a prospective, randomized, placebo-controlled study. (англ.) // Diabetes care. — 2013. — Vol. 36, no. 4. — P. 854—857. — doi:10.2337/dc12-1371. — PMID 23340885.