Катод (от греч. κάθοδος «ход вниз; возвращение») — электрод электронного или электротехнического прибора или устройства, характеризующийся тем, что движение электронов во внешней цепи направлено к нему[1].
Катод в электрохимии и цветной металлургии
правитьВ электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[2], катод никелевый, катод цинковый и т. п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах
правитьВ вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии (термокатод), либо же вследствие фотоэлектронной эмиссии (фотокатод), или автоэлектронной эмиссии (холодный катод). В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов или их оксидов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор из алунда. Оксидный катод прямого накала представляет собой нить (в мощных приборах - проволоку, иногда даже относительно тонкую, но широкую ленту, как в мощных ртутных газотронах) из никеля, покрытую слоем оксидов. Существуют также вольфрамовые, танталовые, молибденовые или рениевые катоды прямого накала, широко распространены катоды из карбидированного (покрытого слоем карбида) вольфрама, легированного оксидом тория, что снижает работу выхода, а карбидирование увеличивает срок службы катода.
Катод у полупроводниковых приборов
правитьЭлектрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом, т. е. в открытом состоянии ток протекает от анода к катоду.
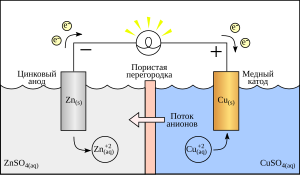
Знак анода и катода
правитьВ литературе встречается различное обозначение знака катода — «−» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «−» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[3][4]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть у гальванического элемента отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «+» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.[4][5][6].
В электротехнике за направление тока принято считать направление движения положительных зарядов, поэтому в вакуумных и полупроводниковых приборах и электролизных ячейках ток течёт от положительного анода к отрицательному катоду, а электроны, соответственно, наоборот, от катода к аноду.
См. также
правитьЛитература
править- ↑ Большая российская энциклопедия. Дата обращения: 17 января 2024. Архивировано 3 октября 2023 года.
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия. Дата обращения: 11 декабря 2016. Архивировано 4 января 2022 года.
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
править- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов (недоступная ссылка)
- Знаем ли мы, что такое АНОД и что такое КАТОД? - Теория, измерения и расчеты.
- Катод // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. III. — ISBN 9965-9746-4-0. (CC BY-SA 3.0)