Иоди́д серебра́(I), устаревшие названия: йодит, йодирит и йодаргирит[2] — бинарное неорганическое соединение иода и серебра с формулой AgI, серебряная соль иодоводородной кислоты.
| Иодид серебра(I) | |||
|---|---|---|---|
 | |||
| Общие | |||
| Хим. формула | AgI | ||
| Рац. формула | AgI | ||
| Физические свойства | |||
| Состояние | жёлтые кристаллы | ||
| Молярная масса | 234,77 г/моль | ||
| Плотность | 5,675 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 558 °C | ||
| • кипения | 1506 °C | ||
| Энтальпия | |||
| • образования | −62,4 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 3⋅10−7 г/100 мл (20 °C); произведение растворимости 8,52 × 10−17 г/100 мл | ||
| Структура | |||
| Дипольный момент | 1,7E−29 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 7783-96-2 | ||
| PubChem | 24563 и 6432717 | ||
| Рег. номер EINECS | 232-038-0 | ||
| SMILES | |||
| InChI | |||
| Номер ООН | 3077 | ||
| ChemSpider | 22969 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Жёлтое вещество, чувствительное к действию света, используется в фотографии. Также находит применение в качестве антисептика в медицине и в качестве дождеобразующего реагента.
Свойства
правитьИодид серебра(I) практически не растворяется в воде.
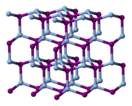
Известно три кристаллических модификациях устойчивых при разных температурах[3]. Ниже 420 К наиболее стабильна β-фаза иодида серебра(I) со структурой типа вюрцита. Эта фаза встречается в природе в виде минерала иодаргирита. Выше 420 К становится более стабильной α-фаза. Этот объемноцентрированная кристаллическая кубическая структура, в которой ионы серебра распределены случайным образом между 6 октаэдрическими, 12 тетраэдрическими и 24 тригональными узлами[4]. В этой структуре при этой температуре ионы подвижны в кристалле, что превращает его в твёрдый электролит и обеспечивает высокую ионную проводимость.
Переход между кристаллическими β- и α-формами можно рассматривать как «плавление» катионной кристаллической подрешетки из ионов серебра. Энтропия плавления α-формы примерно вдвое меньше, чем у хлорида натрия (типичного ионного твердого тела). Это уменьшение энтропии объясняется тем, что кристаллическая решетка уже «частично расплавилась» при переходе между α- и β-полиморфами.
Также известна метастабильная γ-фаза при температуре ниже 420 К с кристаллической структурой типа цинковой обманки.
Получение
правитьПри комнатной температуре в водном растворе при воздействии иодоводорода, или иодида калия, или иодида натрия на нитрат серебра(I), иодид серебра выпадет в осадок:
- .
Способ прямого синтеза из элементов для получения светочувствительного слоя на серебряной поверхности: Этот способ применялся на заре развития фотографии. Медная пластина, покрытая тонким слоем серебра, тщательно отполированная до зеркального блеска, помещается в специальный ящик, полированной стороной вниз. Снизу ящика под пластиной помещается чашка с кристаллическим иодом. При подогреве иод начинает возгоняться и его пары конденсируются на серебряной поверхности. При этом иод реагирует с серебром, поверхность покрывается тонким слоем иодида серебра(I) (при этом становясь светочувствительной, см. Дагеротипия):
- .
Применение
правитьОдна из кристаллических структур очень схожа по строению с таковой у льда, поэтому введение небольшого количества аэрозоля в виде микроскопических кристалликов иодида серебра(I) в дождевое облако вызывает в нём образование центров конденсации водяного пара, тем самым вызывая выпадение осадков. По некоторым оценкам, для этой цели используется около 50 тонн вещества в год — при том, что однократно расходуется от 10 до 50 граммов[5].
Также иодид серебра применяется в качестве светочувствительного вещества в фотографии.
Токсичность
правитьИодид серебра(I) токсичен, при контакте с кожей или вдыхании концентрированных паров возможно отравление. Симптомы отравления: головная боль, слабость, анемия, потеря веса, раздражение слизистых оболочек. При длительном контакте или вдыхании может развиться аргирия[6].
Примечания
править- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Йодит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Binner J. G. P., Dimitrakis G., Price D. M., Reading M., Vaidhyanathan B. Hysteresis in the β–α Phase Transition in Silver Iodide (англ.) // Journal of Thermal Analysis and Calorimetry[англ.] : journal. — 2006. — Vol. 84. — P. 409—412. — doi:10.1007/s10973-005-7154-1. Архивировано 1 июля 2021 года.
- ↑ Hull, Stephen (2007). "Superionics: crystal structures and conduction processes". Rep. Prog. Phys. 67 (7): 1233—1314. doi:10.1088/0034-4885/67/7/R05. S2CID 250874771.
- ↑ Phyllis A. Lyday «Iodine and Iodine Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ↑ Roy J. Iwin (compiler). ENVIRONMENTAL CONTAMINANTS ENCYCLOPEDIA: SILVER ENTRY (англ.) (PDF) (1 июля 1997). Дата обращения: 20 июня 2010. Архивировано 29 апреля 2012 года.
Литература
править- Деннис А. Изменение погоды засевом облаков = Arnett S. Dennis. Weather Modification by Cloud Seeding. Academic Press, 1980. / Арнетт Деннис / Пер. с англ. А. В. Лысака и Е. Д. Стукина; Под ред. Ю. С. Седунова; Науч. ред. Э. А. Медушевская, И. А. Гревцова. — М.: Мир, 1983. — 272 с. — 1400 экз. (в пер.)