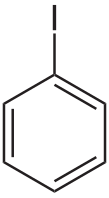
Иодбензол (фенилиодид) — галогенопроизводное бензола, ароматическое органическое соединение, имеющее формулу C6H5l. Часто используется как промежуточный продукт в органическом синтезе. Представляет из себя летучую бесцветную жидкость, которая со временем желтеет.
| Иодбензол | |||
|---|---|---|---|
 | |||
| Общие | |||
| Хим. формула | C6H5I | ||
| Физические свойства | |||
| Состояние | Бесцветная жидкость | ||
| Плотность | 1,823 г/см³ | ||
| Энергия ионизации | 8,69 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −29 °C | ||
| • кипения | 188 °C | ||
| • вспышки | 74,44 °C | ||
| Структура | |||
| Дипольный момент | 5,7E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 591-50-4 | ||
| PubChem | 11575 | ||
| Рег. номер EINECS | 209-719-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | DA3390000 | ||
| ChemSpider | 11087 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
правитьИодбензол есть в продаже, так что в лаборатории получать его нет необходимости. Но если нужно, получают иодбензол из анилина. Первой стадией амино-группа диазотируется хлороводородной кислотой и нитритом натрия. К получающемуся фенилдиазоний хлориду добавляют иодид калия, в результате чего азот выделяется в свободном виде. Получившийся иодбензол отделяют паровой дистилляцией.[2]
Также можно получить иодбензол напрямую из бензола, прилив к нему смесь иода и азотной кислоты.[3]
Реакции
правитьПоскольку связь C-I слабее, чем у других галогенов с углеродом, у иодбензол гораздо выше реакционная способность, чем у бром- или хлорбензола. Иодбензол легко реагирует с магнием, образуя реактив Гриньяра, фенилмагний иодид. Фенилмагний иодид, также как и его бромидный аналог, выступает эквивалентом фенила при рассмотрении синтонов.
Также иодбензол может выступать в качестве субстрата в реакции Соногаширы, Хека и других металл-каталитических реакциях.
Применение
правитьВ лабораториях иногда в качестве твёрдого источника хлора используют комплекс иодбензола дихлорида, получаемого реакцией иодбензола с хлором.[4]
См. также
правитьПримечания
править- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ http://www.orgsyn.org/demo.aspx?prep=cv2p0351 (англ.). www.orgsyn.org. Дата обращения: 22 декабря 2019. Архивировано 13 февраля 2021 года.
- ↑ http://www.orgsyn.org/demo.aspx?prep=cv1p0323 (англ.). www.orgsyn.org. Дата обращения: 22 декабря 2019. Архивировано 21 июля 2019 года.
- ↑ http://www.orgsyn.org/demo.aspx?prep=cv3p0482 (англ.). www.orgsyn.org. Дата обращения: 22 декабря 2019. Архивировано 30 января 2021 года.
Литература
править- Гаттерман Л., Виланд Л. Практические работы по органической химии.