Окси́д ме́ди(I) (гемиокси́д ме́ди, окси́д диме́ди, устар. за́кись ме́ди, купри́т) — бинарное химическое соединение одновалентной меди с кислородом, амфотерный оксид (проявляет слабые кислотные свойства)
| Оксид меди(I) | |
|---|---|
  | |
| Общие | |
| Традиционные названия | Закись меди, гемиоксид меди, оксид димеди |
| Хим. формула | Cu2O |
| Рац. формула | Cu2O |
| Внешний вид | Коричнево-красные кристаллы |
| Физические свойства | |
| Молярная масса | 143,09 г/моль |
| Плотность | 6,1 г/см³ |
| Твёрдость | 3,5 — 4 |
| Термические свойства | |
| Энтальпия | |
| • плавления | +64,22 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 2,4⋅10−7 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 2,85 |
| Структура | |
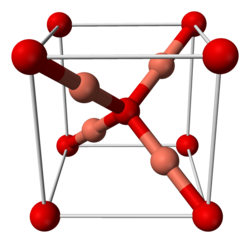
| Кристаллическая структура | кубическая |
| Классификация | |
| Рег. номер CAS | 1317-39-1 |
| PubChem | 10313194 |
| Рег. номер EINECS | 215-270-7 |
| SMILES | |
| InChI | |
| RTECS | GL8050000 |
| ChEBI | 81908 |
| ChemSpider | 8488659 |
| Безопасность | |
| ЛД50 | 470 мг/кг |
| Токсичность | средняя |
| Фразы риска (R) | R22; R50/53 |
| Фразы безопасности (S) | S22; S60; S61 |
| Краткие характер. опасности (H) |
H302, H410 |
| Меры предостор. (P) |
P273, P501 |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |

Нахождение в природе
правитьОксид меди(I) встречается в природе в виде минерала куприта (устаревшие названия: красная медная руда, стекловатая медная руда, рубиновая медь). Цвет минерала красный, коричнево-красный, пурпурно-красный или чёрный. Твёрдость по шкале Мооса 3,5 — 4[1].
Разновидность куприта с удлинёнными нитевидными кристаллами называется халькотрихит (устаревшее название: плюшевая медная руда). Кирпично-красная смесь куприта с лимонитом носит название «черепичная руда»[2].
Физические свойства
правитьОксид меди(I) при нормальных условиях — твёрдое вещество коричнево-красного цвета нерастворимое в воде и этаноле. Плавится без разложения при 1242 °C[2][3].
Оксид меди(I) имеет кубическую сингонию кристаллической решётки, пространственная группа P n3m, a = 0,4270 нм, Z = 2.
Химические свойства
правитьРеакции в водных растворах
правитьОксид меди(I) не реагирует с водой. В очень малой степени (ПР = 1,2⋅10−15) диссоциирует:
Равновесие диспропорционирования:
Оксид меди(I) переводится в раствор:
- концентрированной соляной кислотой
- концентрированной щёлочью (частично)
- концентрированным гидратом аммиака и концентрированными растворами солей аммония
- путём окисления до солей меди(II) различными окислителями (например, концентрированными азотной и серной кислотами, кислородом в разбавленной соляной кислоте)
Также оксид меди(I) вступает в водных растворах в следующие реакции:
- медленно окисляется кислородом до гидроксида меди(II)
- реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди(I):
- в разбавленной серной кислоте дисмутирует на сульфат меди(II) и металлическую медь
- восстанавливается до металлической меди типичными восстановителями, например гидросульфитом натрия в концентрированном растворе
Реакции при высоких температурах
правитьОксид меди(I) восстанавливается до металлической меди в следующих реакциях:
- при нагревании до 1800 °C (разложение)
- при нагревании в токе водорода, монооксида углерода, с алюминием
- при нагревании с серой
Оксид меди(I) может быть окислен до соединений меди(II) в токе кислорода или хлора:
Также, при высоких температурах оксид меди(I) реагирует:
- с аммиаком (образуется нитрид меди(I))
- c оксидами щелочных металлов и бария (образуются двойные оксиды)
Прочие реакции
правитьОксид меди(I) реагирует с азидоводородом:
- при охлаждении выпадает осадок азида меди(II)
- при комнатной температуре в токе азидоводородной кислоты выпадает осадок азида меди(I)
Получение
правитьОксид меди(I) может быть получен:
- нагреванием металлической меди в токе оксида азота(I) или оксида азота(II)
- нагреванием металлической меди с оксидом меди(II)
- термическим разложением оксида меди(II)
- нагреванием сульфида меди(I) в токе кислорода
В лабораторных условиях оксид меди(I) может быть получен восстановлением гидроксида меди(II) (например, гидразином):
Также, оксид меди(I) образуется в реакциях ионного обмена солей меди(I) с щелочами, например:
- в реакции иодида меди(I) с горячим концентрированным раствором гидроксида калия
- в реакции дихлорокупрата(I) водорода с разбавленным раствором гидроксида натрия
В двух последних реакциях не образуется соединения с составом, соответствующим формуле (гидроксид меди(I)). Образование оксида меди(I) происходит через промежуточную гидратную форму переменного состава .
- Окисление альдегидов гидроксидом меди(II). Если к голубому осадку гидроксида меди(II) прилить раствор альдегида и смесь нагреть , то сначала появляется жёлтый осадок гидроксида меди (I):
- при дальнейшем нагревании желтого осадка гидроксида меди (I) превращается в красный оксид меди (I):
- Также, для получения Cu2O в небольших количествах можно использовать методику:
- 1) Готовим 2 раствора. Раствор CuSO4 с его массовой долей 10% и раствор NaOH с его массовой долей 20%. Также необходимо взять твёрдую глюкозу (C6H12O6).
- 2) Ставим стакан с раствором CuSO4 на плитку и добавляем глюкозу.
- 3) Приливаем раствор NaOH в полученную смесь и перемешиваем стеклянной палочкой или на магнитной мешалке.
- 4) Дать раствору отстояться, чтобы частицы осадка Cu2O полностью осадились.
- Выпадение осадка Cu2O происходит по реакции :
- После реакции следует профильтровать раствор через воронку с фильтровальной бумагой или через колбу Бунзена с воронкой Бюхнера, высушить и собрать полученный осадок Cu2O.
Применение
правитьОксид меди(I) применяется как пигмент для окрашивания стекла, керамики, глазурей; как компонент красок, защищающих подводную часть судна от обрастания; в качестве фунгицида[источник не указан 1325 дней].
Обладает полупроводниковыми свойствами, используется в меднозакисных вентилях.
Токсичность
правитьОксид меди(I) — умеренно токсичное вещество: LD50 470 мг/кг (для крыс перорально). Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Очень токсично для водной среды: LC50 для Daphnia magna составляет 0,5 мг/л в течение 48 ч.
Примечания
править- ↑ Куприт на webmineral.com. Дата обращения: 7 июля 2011. Архивировано 29 июня 2017 года.
- ↑ 1 2 Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 104, 226, 464, 532, 604. — 685 с. — ISBN 5-7107-8085-5.
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 148—149. — 637 с. — ISBN 978-5-358-01303-2.
Ссылки
править- Use of Copper-Based Antifouling Paint: A U.S. Regulatory Update Архивная копия от 30 августа 2021 на Wayback Machine
- Antifouling Архивная копия от 30 августа 2021 на Wayback Machine
