Дарунавир
Дарунавир (DRV) — антиретровирусный препарат для профилактики и лечения ВИЧ/СПИДа. Выпускается под торговой маркой Prezista[1].
| Дарунавир | |
|---|---|
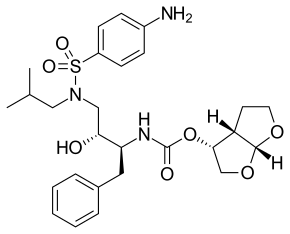 | |
| Химическое соединение | |
| ИЮПАК | [(1R,5S,6R)-2,8-dioxabicyclo[3.3.0]oct-6-yl] N-[(2S,3R)-4- [(4-aminophenyl)sulfonyl- (2-methylpropyl)amino]-3-hydroxy-1-phenyl- butan-2-yl] carbamate |
| Брутто-формула | C27H37N3O7S |
| CAS | 206361-99-1 |
| PubChem | 213039 |
| DrugBank | DB01264 |
| Состав | |
| Классификация | |
| АТХ | J05AE10 |
| МКБ-10 | B24 |
| Фармакокинетика | |
| Биодоступн. | В дозе 600 мг - 37% (без ритонавира), 82% (с ритонавиром, 100 мг 2 раза в день) |
| Связывание с белками плазмы | около 95% |
| Метаболизм | в печени (CYP3A4) |
| Период полувывед. | около 15 часов (с ритонавиром) |
| Экскреция | При приеме в дозе 400 мг (с ритонавиром 100 мг) Кал (79.5%), Моча (13.9%) |
| Лекарственные формы | |
| таблетки, покрытые пленочной оболочкой (75 мг, 150 мг, 300 мг, 400 мг, 600 мг, 800 мг) | |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Дарунавир, Кемерувир, САЛДУВИР, Вирнада | |
Дарунавир часто используется в сочетании с другими антиретровирусными препаратами[1][2], комбинированный препарат дарунавира и кобицистата (Резолста) выпускается в виде одной таблетки[3].
Описание
правитьДарунавир был разработан для усиления взаимодействия с протеазой ВИЧ-1 и повышения устойчивости к мутациям протеазы ВИЧ-1[4].
На 2009 год в США и Великобритании затраты на здравоохранение при использовании усиленного дарунавира были ниже, чем при использовании других ингибиторов протеазы[5].
История
правитьДарунавир был одобрен для медицинского применения в США в 2006 г. и в Европейском Союзе в феврале 2007 года[1][6][7][8][9][10][6].
Первым ингибитором протеазы ВИЧ, одобренным FDA, был саквинавир, который был разработан для воздействия на протеазу дикого типа ВИЧ-1[11]. Однако этот ингибитор больше не эффективен из-за вызывающих резистентность мутаций в структуре протеазы ВИЧ-1. Геном ВИЧ обладает высокой пластичностью, поэтому он стал устойчивым ко многим ингибиторам протеазы ВИЧ-1[12]. После саквинавира FDA одобрило несколько PIs, включая дарунавир[9].
Медицинское использование
правитьДарунавир рекомендован Министерством здравоохранения и социальных служб США (DHHS) для лечения взрослых и подростков, независимо от того, получали ли они лечение от ВИЧ в прошлом[13]. В исследовании пациентов, которые никогда не получали лечения от ВИЧ, дарунавир был так же эффективен, как лопинавир/ритонавир, через 96 недель при дозировке один раз в день[14]. Дарунавир был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) 21 октября 2008 года для людей, ранее не лечившихся от ВИЧ[15]. Как и другие антиретровирусные препараты, Дарунавир не лечит ВИЧ/СПИД[16].
Дарунавир показан для лечения инфекции вируса иммунодефицита человека (ВИЧ-1) у взрослых и детей в возрасте от трех лет и старше при совместном применении с ритонавиром в сочетании с другими антиретровирусными средствами[2][6].
Он часто используется с низкими дозами ритонавира или кобицистата для повышения уровня дарунавира[1]. Его можно использовать для профилактики после укола иглой или другого потенциального воздействия[1]. Дарунавир принимают перорально от одного до двух раз в день[1].
Побочные эффекты
правитьДарунавир обычно хорошо переносится людьми. Наиболее частым побочным эффектом (7% пациентов) является сыпь[16]. Другими частыми побочными эффектами являются диарея (2,3%), головная боль (3,8%), боль в животе (2,3%), запор (2,3%) и рвота (1,5%)[16]. Дарунавир также может вызывать аллергические реакции, и люди с аллергией на ритонавир также могут иметь реакцию на дарунавир[16].
Общие побочные эффекты включают диарею, тошноту, боли в области живота и таза, головную боль, сыпь и рвоту[1][2]. Серьезные побочные эффекты включают аллергические реакции, проблемы с печенью и кожные высыпания, такие как токсический эпидермальный некролиз[1]. Несмотря на то, что действие препарата во время беременности мало изучен, он безопасен для ребенка[17]. Он относится к классу ингибиторов протеазы (PIs) и действует путем блокирования протеазы ВИЧ[1]. Дарунавир включен в Примерный перечень ВОЗ основных лекарственных средств[18].
Сообщалось о высоком уровне сахара в крови, диабете или обострении диабета, мышечной боли, болезненности или слабости, а также учащении кровотечений у людей с гемофилией у пациентов, принимающих лекарства с ингибиторами протеазы, такие как дарунавир[16]. У некоторых пациентов, принимающих лекарства от ВИЧ, наблюдались изменения в жировой ткани, включая потерю жира на ногах, руках и лице, увеличение жира в животе и других внутренних органах, увеличение груди и жировые образования на задней части шеи. Причины и долгосрочные последствия этих состояний для здоровья неизвестны[16].
Взаимодействие лекарственных средств
правитьДарунавир может взаимодействовать с лекарствами, обычно принимаемыми людьми с ВИЧ/СПИДом, такими как другие антиретровирусные препараты, и антацидами, такими как ингибиторы протонной помпы и Блокаторы H2-гистаминовых рецепторов[16]. Зверобой продырявленный может снизить эффективность дарунавира за счет увеличения расщепления дарунавира метаболическим ферментом CYP3A[16].
Примечания
править- ↑ 1 2 3 4 5 6 7 8 9 Darunavir. The American Society of Health-System Pharmacists. Дата обращения: 28 ноября 2016. Архивировано 10 ноября 2016 года.
- ↑ 1 2 3 Prezista — darunavir. DailyMed (6 июня 2019). Дата обращения: 21 апреля 2020. Архивировано 6 февраля 2019 года.
- ↑ Darunavir / Cobicistat. AIDSinfo. U.S. Department of Health and Human Services. Дата обращения: 1 апреля 2021. Архивировано 3 марта 2020 года.
- ↑ King, N. M. Structural and Thermodynamic Basis for the Binding of TMC114, a Next-Generation Human Immunodeficiency Virus Type 1 Protease Inhibitor : [англ.] / N. M. King, M. Prabu-Jeyabalan, E. A. Nalivaika … [et al.] // Journal of Virology. — 2004. — Vol. 78, no. 21. — P. 12012–12021. — doi:10.1128/JVI.78.21.12012-12021.2004. — PMID 15479840. — PMC 523255.
- ↑ 1 2 3 Prezista EPAR. European Medicines Agency (EMA). Дата обращения: 21 апреля 2020. Архивировано 25 июня 2019 года.
- ↑ MacArthur, Rodger D (2007). "Darunavir: promising initial results". The Lancet. 369 (9568): 1143–1144. doi:10.1016/S0140-6736(07)60499-1 Архивная копия от 2 июля 2018 на Wayback Machine. PMID 17416241 Архивная копия от 24 июля 2021 на Wayback Machine. S2CID 31175809.
- ↑ "FDA Approves New HIV Treatment for Patients Who Do Not Respond to Existing Drugs". U.S. Food and Drug Administration (FDA) (Press release). Архивировано из оригинала 13 ноября 2016. Дата обращения: 10 ноября 2016.
{{cite press release}}: Указан более чем один параметр|accessdate=and|access-date=(справка) - ↑ 1 2 HIV/AIDS Historical Time Line 2000 - 2010. U.S. Food and Drug Administration (5 января 2018). Дата обращения: 21 апреля 2020. Архивировано из оригинала 1 июня 2019 года.
- ↑ Drug Approval Package: Prezista (Darumavir) NDA #021976. U.S. Food and Drug Administration (FDA) (6 сентября 2006). Дата обращения: 21 апреля 2020. Архивировано 1 июля 2016 года.
- ↑ Liu, F.; Kovalevsky, A.Y. (2008). "Effect of Flap Mutations on Structure of HIV-1 Protease and Inhibition by Saquinavir and Darunavir". J. Mol. Biol. 381 (1): 102—115. doi:10.1016/j.jmb.2008.05.062. PMC 2754059. PMID 18597780.
- ↑ Eron, J (2000). "HIV-1 Protease Inhibitors". Oxford Journal of Clinical Infectious Diseases. 30: 160—170. doi:10.1086/313853. PMID 10860901.
- ↑ Panel on Antiretroviral Guidelines for Adults and Adolescents (2019-12-18). "Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV" (Document). Department of Health and Human Services.
{{cite document}}: Неизвестный параметр|access-date=игнорируется (справка); Неизвестный параметр|archive-date=игнорируется (справка); Неизвестный параметр|archive-url=игнорируется (справка); Неизвестный параметр|lay-url=игнорируется (справка); Неизвестный параметр|url-status=игнорируется (справка); Неизвестный параметр|url=игнорируется (справка) - ↑ hivandhepatitis.com Архивировано 13 июля 2007 года., Efficacy and Safety of Boosted Darunavir (Prezista) Are Superior to Lopinavir/ritonavir (Kaletra) at 96 Weeks: ARTEMIS Trial, 2008-10-28, URL Архивировано 19 июля 2009 года..
- ↑ hivandhepatitis.com Архивировано 13 июля 2007 года., Darunavir (Prezista) Receives Full Traditional Approval, Dose Set for Treatment-naive Patients, Caution Urged for Pregnant Women, 2008-10-24, URL Архивировано 19 мая 2009 года..
- ↑ 1 2 3 4 5 6 7 8 Drug Monograph, Prezista. Архивировано 11 ноября 2016 года.
- ↑ Darunavir (Prezista) Use During Pregnancy. Drugs.com (23 октября 2018). Дата обращения: 21 апреля 2020. Архивировано 20 декабря 2016 года.
- ↑ World Health Organization model list of essential medicines: 21st list 2019. — Geneva : World Health Organization, 2019. — ISBN WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.