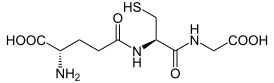
Глутатион (2-амино-5-{[2-[(карбоксиметил)амино]-1-(меркаптометил)-2-оксоэтил]амино}-5-оксопентаноевая кислота, англ. glutathione, GSH) — это трипептид γ-глутамилцистеинилглицин. Глутатион содержит необычную пептидную связь между аминогруппой цистеина и карбоксильной группой боковой цепи глутамата. Значение глутатиона в клетке определяется его антиоксидантными свойствами. Фактически глутатион не только защищает клетку от токсичных свободных радикалов, но и в целом определяет окислительно-восстановительные характеристики внутриклеточной среды[1].
| Глутатион | |
|---|---|
   | |
| Общие | |
| Систематическое наименование |
(2S)-2-Amino-4-'"`UNIQ--nowiki-00000000-QINU`"'{[(1R)-1-[(carboxymethyl)carbamoyl]-2-sulfanylethyl]carbamoyl}butanoic acid |
| Хим. формула | C10H17N3O6S |
| Физические свойства | |
| Молярная масса | 307.32 г/моль |
| Классификация | |
| Рег. номер CAS | 70-18-8 |
| PubChem | 124886 и 25246407 |
| Рег. номер EINECS | 200-725-4 |
| SMILES | |
| InChI | |
| ChEBI | 16856 |
| ChemSpider | 111188 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
В клетке тиоловые группы находятся в восстановленном состоянии (SH). Концентрация глутатиона в клетке составляет около 5 мМ. Фактически такая высокая концентрация глутатиона в клетке приводит к тому, что он восстанавливает любую дисульфидную связь (S-S), образующуюся между остатками цистеина внутриклеточных белков. При этом восстановленная форма глутатиона GSH превращается в окисленную GSSG. Восстанавливается окисленный глутатион под действием фермента глутатионредуктазы, который постоянно находится в клетке в активном состоянии и индуцируется при окислительном стрессе. Соотношение восстановленной и окисленной форм глутатиона в клетке является одним из важнейших параметров, который показывает уровень окислительного стресса.
Биосинтез
правитьГлутатион не является незаменимым веществом и может быть синтезирован из аминокислот L-цистеина, L-глутаминовой кислоты и глицина.
Синтез происходит в две АТФ-зависимые стадии:
- на первой стадии синтезируется γ-глутамилцистеин из глутаминовой кислоты и цистеина ферментом γ-глутамилцистеинсинтетазой (или глутаматцистеинлигазой). Данная реакция является лимитирующей в синтезе глутатиона;
- на второй стадии фермент глутатионсинтетаза присоединяет остаток глицина к С-концевой группе γ-глутамилцистеина.
Глутаматцистеинлигаза
правитьФермент глутаматцистеинлигаза (GCL) это гетеродимер, состоящий из каталитической (GCLC) и регуляторной субъединиц (GCLM). Каталитическая субъединица обеспечивают каталитическую активность фермента, а регуляторная — повышает каталитическую эффективность. Мыши, не имеющие гена каталитической субъединицы, умирают до рождения[2]. Мыши, не имеющие гена регуляторной субъединицы, фенотипически мало отличаются от нормальных, хотя характеризуются пониженным уровнем глутатиона (GSH) и более чувствительны к воздействиям, вызывающим окислительный стресс[3][4][5].
Все клетки организма человека способны синтезировать глутатион, тем не менее глутатионсинтетаза в печени крайне важна. После рождения мыши, у которых ген каталитической субъединицы не экспрессируется только в печени, живут не более одного месяца. Смерть вызвана повреждением митохондрий и печёночной недостаточностью[6].
Путь биосинтеза глутатиона показан для некоторых прокариот (цианобактерий и протеобактерий), но отсутствует у многих бактерий. Многие эукариоты синтезируют глутатион, например, человек, но некоторые не синтезируют, например, Leguminosae, Entamoeba, и Giardia. Из архей глутатитон могут синтезировать только галобактерии[7][8].
Функция
правитьГлутатион участвует в синтезе лейкотриенов и является кофактором фермента глутатионпероксидазы. Он также выступает в качестве гидрофильной молекулы, которая присоединяется ферментами печени к гидрофобным токсичным веществам в процессе их биотрансформации с целью выведения из организма в составе желчи. Как часть глиоксалазной ферментативной системы глутатион участвует в реакции детоксификации метилглиоксаля, токсичного побочного продукта метаболизма. Глиоксалаза I (КФ 4.4.1.5 Архивная копия от 16 мая 2011 на Wayback Machine) превращает метилглиоксаль и восстановленный глутатион в лактоилглутатион. Глиоксалаза II (КФ 3.1.2.6 Архивная копия от 16 мая 2011 на Wayback Machine) гидролизует лактоилглутатион с образованием глутатиона и лактата (молочной кислоты).
Глутатион является субстратом реакций конъюгации и восстановления, катализируемых глутатион-S-трансферазой в цитозоле, микросомах и в митохондриях.
Глутатион плохо всасывается в желудочно-кишечном тракте[9][10], поэтому для восстановления нормального уровня глутатиона при патологических состояниях назначают N-ацетилцистеин[11][12].
Примечания
править- ↑ Strużńka L., Chalimoniuk M., Sulkowski G. The role of astroglia in Pb-exposed adult rat brain with respect to glutamate toxicity (англ.) // Toxicology : journal. — 2005. — September (vol. 212, no. 2—3). — P. 185—194.
- ↑ Dalton, TP; et al. Knockout of the Mouse Glutamate Cysteine Ligase Catalytic Subunit (Gclc) Gene: Embryonic Lethal When Homozygous, and Proposed Model for Moderate Glutathione Deficiency When Heterozygous (англ.) // Biochem Biophys Res Commun. : journal. — 2000. — Vol. 279, no. 2. — P. 324. — doi:10.1006/bbrc.2000.3930.
- ↑ Yang Y., et al. Initial Characterization of the Glutamate-Cysteine Ligase Modifier Subunit Gclm(-/-) Knockout Mouse. NOVEL MODEL SYSTEM FOR A SEVERELY COMPROMISED OXIDATIVE STRESS RESPONSE (англ.) // Journal of Biological Chemistry : journal. — 2002. — Vol. 277, no. 51. — P. 49446. — doi:10.1074/jbc.M209372200. — PMID 12384496.
- ↑ Giordano G., et al. Organophosphorus insecticides chlorpyrifos and diazinon and oxidative stress in neuronal cells in a genetic model of glutathione deficiency (англ.) // Toxicol Appl Pharmacol[англ.] : journal. — 2007. — Vol. 219, no. 2—3. — P. 181. — doi:10.1016/j.taap.2006.09.016.
- ↑ McConnachie L.A., Mohar I., Hudson F.N., et al. Glutamate cysteine ligase modifier subunit deficiency and gender as determinants of acetaminophen-induced hepatotoxicity in mice (англ.) // Toxicol Sci. : journal. — 2007. — October (vol. 99, no. 2). — P. 628—636. — doi:10.1093/toxsci/kfm165. — PMID 17584759.
- ↑ Chen Y., et al. Hepatocyte-specific GCLC deletion leads to rapid onset of steatosis with mitochondrial injury and liver failure (англ.) // Hepatology[англ.] : journal. — Wiley-Liss, 2007. — Vol. 45. — P. 1118. — doi:10.1002/hep.21635.
- ↑ Shelley D. Copley and Jasvinder K. Dhillon. Lateral gene transfer and parallel evolution in the history of glutathione biosynthesis genes (англ.) // Genome biology : journal. — 2002. — Vol. 3. — P. research0025.1. — doi:10.1186/gb-2002-3-5-research0025. Архивировано 5 июня 2008 года.
- ↑ Grill D, Tausz T, De Kok LJ. Significance of glutathione in plant adaptation to the environment (англ.). — Springer, 2001. — ISBN 1402001789.
- ↑ AIDS Line Update Архивная копия от 4 апреля 2007 на Wayback Machine
- ↑ Witschi A, et. al. The systemic availability of oral glutathione. Eur J Clin Pharmacol. 1992;43(6):667-9
- ↑ Glutathione information for Physicians. Дата обращения: 2 мая 2007. Архивировано 28 апреля 2007 года.
- ↑ Biochemical manipulation of intracellular glutathione levels influences cytotoxicity to isolated human lymphocytes by sulfur mustard.
В другом языковом разделе есть более полная статья Glutathione (англ.). |