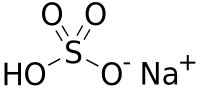
Гидросульфа́т на́трия — кислая соль натрия и серной кислоты с формулой NaHSO4, бесцветные кристаллы. Образует кристаллогидрат NaHSO4·H2O.
| Гидросульфат натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гидросульфат натрия |
| Традиционные названия | Кислый сернокислый натрий, бисульфат натрия |
| Хим. формула | NaHSO4 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 120 г/моль |
| Плотность | 2,472 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 186 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 28,60; 50100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7681-38-1 |
| PubChem | 516919 и 22466163 |
| Рег. номер EINECS | 231-665-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E514(ii) |
| RTECS | VZ1860000 |
| ChemSpider | 56397 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
править- Гидросульфат натрия получают действием серной кислоты на гидроксид или сульфат натрия:
Физические свойства
править- Гидросульфат натрия образует бесцветные кристаллы триклинной сингонии, пространственная группа P 1, параметры ячейки a = 0,7005 нм, b = 0,7125 нм, c = 0,6720 нм, α = 95,93°, β = 92,31°, γ = 75,52°, Z = 4. При нагревании претерпевает два полиморфных перехода при 140 и 170 °C.
- Кристаллогидрат гидросульфата натрия — бесцветные гигроскопические кристаллы моноклинной сингонии, пространственная группа A a, параметры ячейки a = 0,8213 нм, b = 0,7812 нм, c = 0,7805 нм, β = 120,04°, Z = 4.
Химические свойства
править- При нагревании в вакууме гидросульфат натрия переходит в пиросульфат натрия:
- При подщелачивании гидросульфат натрия переходит в сульфат:
- При спекании гидросульфат натрия взаимодействует с солями:
- и оксидами:
Применение
править- Как флюс в цветной металлургии.
- Как реагент для перевода труднорастворимых окислов в растворимые сульфаты.
- Зарегистрирован в качестве пищевой добавки E514.
- в виде порошка или гранул в качестве реагента, понижающего уровень рН в бассейнах
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Химические свойства неорганических веществ: Учеб. пособие для вузов — 3-е изд., испр — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |
