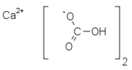
Гидрокарбонат кальция
Гидрокарбона́т ка́льция (бикарбонат кальция, двууглекислый кальций) — неорганическое химическое соединение, кислая соль кальция и угольной кислоты. Химическая формула — . Существует лишь в растворах. Неядовит[1].
| Гидрокарбонат кальция | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Гидрокарбонат кальция | ||
| Традиционные названия | Гидрокарбонат кальция; бикарбонат кальция, кислый углекислый кальций, двууглекислый кальций | ||
| Хим. формула | C2H2CaO6 | ||
| Рац. формула | Ca(HCO3)2 | ||
| Физические свойства | |||
| Молярная масса | 162.1124 г/моль | ||
| Классификация | |||
| Рег. номер CAS | 3983-19-5 | ||
| PubChem | 10176269, 10176262, 129627764 и 101283493 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | Е170(ii) | ||
| ChemSpider | 8351767 | ||
| Безопасность | |||
| Предельная концентрация | 6 мг/дм³ | ||
| ЛД50 | 6420-24000 мг/кг | ||
| Токсичность | Класс опасности IV | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Свойства
правитьВсе гидрокарбонаты растворимы в воде. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций[уточнить] в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Особенности обращения, биологическое действие
правитьНормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³.
Сферы использования
правитьБикарбонат кальция нашёл некоторое применение в качестве пищевой добавки Е170(ii).
Токсикология
правитьВещество нетоксично. ПДК 180 мг/дм³ (в воде, по ионам кальция). ЛД50 на крысах - 6420-24000 мг/кг.
Получение
правитьГидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
Либо действием избытка углекислого газа на раствор гидроксида кальция:
Примечания
править- ↑ Гидрокарбонат кальция — свойства, получение и применение. Chemical Portal (25 июля 2020). Дата обращения: 28 августа 2022. Архивировано 28 августа 2022 года.
См. также
правитьВ статье не хватает ссылок на источники (см. рекомендации по поиску). |