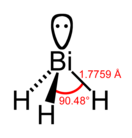
Висмути́н — химическое соединение с формулой BiH3, тяжёлый токсичный газ. Это самый тяжёлый аналог аммиака. BiH3 очень неустойчив при комнатной температуре, разлагаться на висмут и водород начинает при температуре гораздо ниже 0 °C, притом наличие висмута и водорода каталитизируют дальнейшее разложение висмутина (автокатализ). Соединение имеет пирамидальную структуру с углами между H-Bi-H примерно 90°[2].
| Висмутин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
тригидрид висмута, висмутин | ||
| Традиционные названия | висмутовый водород | ||
| Хим. формула | BiH3 | ||
| Физические свойства | |||
| Молярная масса | 212 г/моль | ||
| Плотность | г. 8,665 г/л[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −67 °C[1] | ||
| • кипения | 16,8 °C | ||
| • разложения | <0 °C | ||
| Структура | |||
| Координационная геометрия | тригональная пирамидальная | ||
| Классификация | |||
| Рег. номер CAS | 18288-22-7 | ||
| PubChem | 9242 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30421 | ||
| ChemSpider | 8886 | ||
| Безопасность | |||
| Токсичность |
ядовит |
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Термин висмутин также является основополагающим для семьи висмутоорганических соединений(III), общими для которых является формула BiR3, где R — органический радикал. В качестве примера, Bi(CH3)3 — это соединение имеет название триметилвисмут.
Получение и свойства
правитьВ целом гидриды элементов V группы менее устойчивы, чем элементов IV и VI групп. При давлении в 1 атмосферу и температуре 300 °C в равновесной смеси находится около 3 % NH3. Стибин и висмутин медленно разлагаются уже при комнатной температуре[3]:53.
BiH3 получить достаточно сложно. Попытки синтезировать висмутин путём прямого взаимодействия атомарного водорода с элементарным висмутом не дали положительного результата[3]:53. Обычно его получают перегруппировкой металловисмутинов BiH2Me (здесь Me = метил)[4].
Метилвисмутин BiH2Me также термически неустойчив. Его получают с помощью метилвисмута дихлорида, BiCl2Me, восстанавливая его с помощью алюмогидрида лития LiAlH4[2].
В небольших количествах образуется при действии разбавленных кислот на висмутиды щелочных или щёлочноземельных металлов, однако получаемый таким способом висмутин крайне неустойчив и сразу разлагается. Это обстоятельство в течение полутора сотен лет мешало детально изучить химические свойства висмутина[5].
Являясь гомологом арсина, BiH3 имеет общую с ним тенденцию к резкому росту неустойчивости в присутствии элементов-образователей, соответственно висмута и водорода. Газ разлагается по реакции:
Газ висмутин получается при использовании пробы Марша, при этом быстро разлагаясь и образуя висмутовое зеркало подобно арсину. Проба Марша может обнаруживать присутствие As, Sb и Bi. Различить эти три элемента можно по их растворимости в некоторых веществах: As растворяется в гипохлорите натрия NaOCl, Sb растворяется в полисульфиде аммония, а висмут не растворяется ни в одном из них[4].
Использование и опасность соединения
правитьВисмутин токсичен и нестабилен, что делает его получение сложным процессом, и по этой же причине практического применения висмутин не имеет. Его получают в основном для исследования или как побочный продукт при проведении пробы Марша на висмут. Для хранения висмутина необходимы низкие температуры.
Ссылки
править- ↑ 1 2 CRC Handbook of Chemistry and Physics. — 95th Ed. — CRC Press, 2014. — С. 4—52.
- ↑ 1 2 Jerzembeck W. et al. Bismuthine BiH3: Fact or Fiction? High-Resolution Infrared, Millimeter-Wave, and Ab Initio Studies (англ.) // Angew. Chem. Int. Ed. : journal. — 2002. — Vol. 41, no. 14. — P. 2550—2552. — doi:10.1002/1521-3773(20020715)41:14<2550::AID-ANIE2550>3.0.CO;2-B. Архивировано 5 января 2013 года.
- ↑ 1 2 Н. А. Галактионова. Водород в металлах. — М.: Государственное научно-техническое издаательство по чёрной и цветной металлургии, 1959 г.
- ↑ 1 2 Holleman A. F., Wiberg E. Inorganic Chemistry (англ.). — San Diego: Academic Press, 2001. — ISBN 0-12-352651-5.
- ↑ Некрасов Б. В. Основы общей химии (в двух томах). — Изд. 2-е, стереотип. — М.: Химия, 1969 . — Т. 1. — С. 452.