Аценафтен (1,2-дигидроаценафтилен, трицикло-[6.3.1.04,12]-додека-1(12),4,6,8,10-пентаен) С12Н10 — ароматический углеводород, содержащий 2 конденсированных бензольных кольца.
| Аценафтен | |
|---|---|
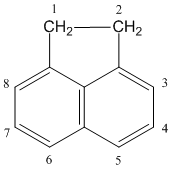 | |
| Общие | |
| Систематическое наименование |
Аценафтен |
| Традиционные названия | 1,2-дигидроаценафтилен |
| Хим. формула | С12Н10 |
| Физические свойства | |
| Молярная масса | 154,20 г/моль |
| Энергия ионизации | 7,68 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 96 °C |
| • кипения | 279 °C |
| Структура | |
| Дипольный момент | 2,8E−30 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 83-32-9 |
| PubChem | 6734 |
| Рег. номер EINECS | 201-469-6 |
| SMILES | |
| InChI | |
| RTECS | AB1000000 |
| ChEBI | 22154 |
| Номер ООН | 3077 |
| ChemSpider | 6478 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Открытие
правитьАценафтен был открыт в 1866 г. французским химиком Бертло.
Физические свойства
правитьАценафтен представляет собой бесцветные игольчатые кристаллы. Растворим в этаноле, толуоле, бензоле; трудно растворим в воде.
Химические свойства
правитьПо химическим свойствам аценафтен сходен с нафталином, но значительно более реакционноспособен. Легко вступает в реакции электрофильного замещения — хлорируется, бромируется, сульфируется, нитруется. При действии хромпика образует нафталевую кислоту, перманганат калия в щелочной среде окисляет аценафтен до гемимеллитовой кислоты.
Аценафтен ступенчато гидрируется до тетра- и декагидроаценафтена. При каталитическом или термическом дегидрировании даёт аценафтилен. При действии сульфурилхлорида в органической среде в присутствии хлорида алюминия образует 5,6-дихлораценафтен.
Конденсируется с формальдегидом с образованием смолы (темп.пл. +126—128°С). При окислении этой смолы образуется трикарбоновая кислота состава С13Н8О8. С литием даёт дигидродилитицаценафтен.
Получение
правитьАценафтен получают из каменноугольной смолы и очищают перекристаллизацией из этанола.
Применение
правитьАценафтен — это химическое промежуточное соединение, используемое для производства нафталимидных красителей, которые используются в качестве флуоресцентных отбеливающих агентов, и применяются в производстве пластмасс, инсектицидов и фунгицидов[2].
Физиологическое действие
правитьЭтот раздел статьи ещё не написан. |
Примечания
править- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Sanjay Chanda, Harihara M. Mehendale. Acenaphthene (англ.) // Encyclopedia of Toxicology (Second Edition) / Philip Wexler. — New York: Elsevier, 2005-01-01. — P. 11–13. — ISBN 978-0-12-369400-3. — doi:10.1016/b0-12-369400-0/00007-7. Архивировано 1 июля 2022 года.
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Краткая химическая энциклопедия./ Аценафтен. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1961 год. — Т. 1.
- М. М. Дашевский. Аценафтен. — М.: «Химия», 1966 год.
