Триэтилалюминий
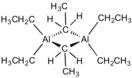
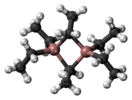
Триэтилалюминий — элементоорганическое вещество, алкилпроизводное алюминия с формулой Al(C2H5)3, бесцветная жидкость, самовоспламеняется на воздухе.
| Триэтилалюминий | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Триэтилалюминий | ||
| Хим. формула | Al(C2H5)3 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса |
114,16димер 228,33 г/моль |
||
| Плотность | 0,832425 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -52,5; -46 °C | ||
| • кипения | 128-130; 185,6; 194; 207 °C | ||
| Классификация | |||
| Рег. номер CAS | 97-93-8 | ||
| PubChem | 16682930 | ||
| Рег. номер EINECS | 202-619-3 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 10179159 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
править- Взаимодействие хлорида алюминия и гидрида натрия (с образованием промежуточного гидрида алюминия) с этиленом:
Физические свойства
правитьТриэтилалюминий — бесцветная жидкость, которая самовоспламеняется на воздухе. Поэтому работать с ним можно только в инертной атмосфере (азот или аргон). Триэтилалюминий образует димеры, в котором расстояния Al-C неэквивалентны, то есть реальная формула Al2(C2H5)6 или (Al(C2H5)3)2.
Химические свойства
править- Энергично реагирует с водой:
- Окисляется до алкоголята:
- С углекислым газом образует пропионат алюминия:
Применение
править- В промышленности в качестве промежуточного продукта в производстве жирных спиртов.
- Пирофорный воспламенитель в ракетной технике.
- Компонент напалмовых смесей.
- Катализатор химических реакций полимеризации (совместно с хлоридом титана).
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Это заготовка статьи по химии. Помогите Википедии, дополнив её. |