Реакция Соногаширы — катализируемое палладием и медью кросс-сочетание винил- и арилгалогенидов с терминальными алкинами[1]. В ходе данной реакции образуется углерод-углеродная связь между sp²-атомом галогенида и sp-атомом алкина. Её отличие от других реакций кросс-сочетания заключается в том, что один из субстратов реакции — алкин — не нужно предварительно активировать, переводя его в какое-либо металлоорганическое соединение. Реакция Соногаширы может протекать в присутствии широкого спектра других функциональных групп, что особенно важно в синтезе сложных молекул, где реакция и нашла своё широкое применение[2].
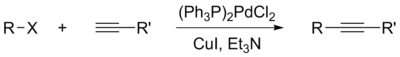
История
правитьРеакция Соногаширы берёт начало из процессов, катализируемых медью, которые активно изучались в 1950-х годах. В этом смысле она похожа на реакцию Кастро — Стефенса[англ.] (взаимодействие ацетиленидов меди с галогенидами). Сочетание алкинов и органических галогенидов, катализируемое палладием, впервые независимо описали Хек и Кассар в одном номере издания Journal of Organometallic Chemistry в 1975 году. Для данного сочетания Хек применил типичные условия реакции Хека, используя амины в качестве основания и растворителя, в то время как Кассар проводил реакцию под действием метилата натрия в диметилформамиде. И в том, и в другом случае для проведения реакции требовалась высокая температура[3].
В то же время Соногасира и сотрудники исследовали реакционную способность алкинов по отношению к металлам и обнаружили, что ацетилениды меди успешно переметаллируются при взаимодействии с платиной, а образующиеся ацетилениды платины активно реагируют с терминальными алкинами. Соногашира предложил провести переметаллирование алкинов с использованием палладия — металла с известной каталитической активностью. Через несколько месяцев после публикаций Хека и Кассара он описал 15 примеров кросс-сочетания алкинов и арил-/винилгалогенидов при комнатной температуре и с добавлением иодида меди CuI в качестве сокатализатора[3].
Условия реакции
правитьТипичные условия реакции были описаны Соногасирой в статье 1975 года, где в качестве примера приведено двойное кросс-сочетание 1,4-дийодбензола с фенилацетиленом, которое протекало с высоким выходом в присутствии 0,5 мол. % палладиевого катализатора и 1 мол. % иодида меди в диэтиламине. Там же было описано двойное кросс-сочетание с участием двух терминальных атомов водорода ацетилена[3].
Механизм
правитьПринято считать, что реакция Соногаширы протекает через двойной каталитический цикл. Каталитический цикл палладия (цикл А) похож на каталитические циклы в реакциях Сузуки и Хека, а вспомогательный каталитический цикл меди (цикл Б) способствует переносу ацетиленовой группы к атому палладия. Несмотря на то, что однозначно протекание того или иного каталитического цикла трудно подтвердить экспериментально, основной цикл представляют в виде трёх стадий:
- окислительного присоединения галогенида к каталитической частице;
- переметаллирования;
- восстановительного элиминирования продукта реакции[4].
Ключевой каталитической частицей в основном цикле служит комплекс палладия(0) (например, Pd(PPh3)2 или другой), который может вводиться в виде тетракис(трифенилфосфин)палладия, либо генерироваться in situ из комплекса палладия(II) путём его восстановления избытком фосфина или алкина. В оригинальной работе Соногаширы катализатор образуется за счёт восстановительного сочетания «жертвенного» алкина (цикл Б'): две ацетиленовые группы под действием основания и меди переносятся к атому палладия, после чего элиминируются с образованием диацетилена, и происходит образование низкокоординированного комплекса палладия[4].
Каталитический цикл палладия начинается со стадии окислительного присоединения, в ходе которого винилгалогенид или арилгалогенид присоединяется к катализатору с разрывом связи С–Х и образованием комплекса палладия(II). Затем комплекс присоединяет алкиновый лиганд через стадию переметаллирования. Этому процессу способствует сокаталитический цикл меди, в котором терминальный алкин превращается в соответствующий ацетиленид меди(I) через промежуточное образование π-комплекса с медью. Наконец, последняя стадия восстановительного элиминирования приводит к продукту реакции[4].
Реакционная способность галогенидов в реакции Соногаширы коррелирует с их способностью вступать в окислительное присоединение: она уменьшается от иодидов к хлоридам:
[4] Для иодидов и электронодефицитных трифлатов и бромидов окислительное присоединение протекает быстро, а лимитирующей стадией является переметаллирование ацетиленида меди, которое происходит медленнее. В случае богатых электронами бромидов и хлоридов лимитирующей стадией является окислительное присоединение[4].
Примечания
править- ↑ Ли Дж. Дж. Именные реакции. Механизмы реакции в органической химии = Name Reactions. A Collection of Detailed Reaction Mechanisms / Пер. с англ. В. М. Демьянович. — М.: Бином. Лаборатория знаний, 2006. — С. 323. — ISBN 5-94774-368-X.
- ↑ Li, 2009, p. 100—102.
- ↑ 1 2 3 Li, 2009, p. 102—103.
- ↑ 1 2 3 4 5 Li, 2009, p. 104—106.
Литература
правитьОригинальные работы
- Cassar L. Synthesis of aryl- and vinyl-substituted acetylene derivatives by the use of nickel and palladium complexes (англ.) // J. Organomet. Chem. — 1975. — Vol. 93, no. 2. — P. 253—257. — doi:10.1016/S0022-328X(00)94048-8.
- Dieck H. A., Heck F. R. Palladium catalyzed synthesis of aryl, heterocyclic and vinylic acetylene derivatives (англ.) // J. Organomet. Chem. — 1975. — Vol. 93, no. 2. — P. 259—263. — doi:10.1016/S0022-328X(00)94049-X.
- Sonogashira K., Tohda Y., Hagihara N. A convenient synthesis of acetylenes: catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines (англ.) // Tetrahedron Letters. — 1975. — Vol. 16, no. 50. — P. 4467—4470. — doi:10.1016/S0040-4039(00)91094-3.
Русскоязычные источники
- Смит В. А., Дильман А. Д. Глава 5.4.3. Реакция Соногаширы // Основы современного органического синтеза. — М.: Бином. Лаборатория знаний, 2009. — С. 126—129. — ISBN 978-5-94774-941-0.
Книги и обзорные статьи
- Chinchilla R., Najera C. The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry (англ.) // Chem. Rev. — 2007. — Vol. 107, no. 3. — P. 874—922. — doi:10.1021/cr050992x. — PMID 17305399.
- Li J. J. Chapter 1. Organometallics // Name Reactions for Homologation, Part I. — John Wiley & Sons, 2009. — P. 100—132. — doi:10.1002/9780470487020.ch1.